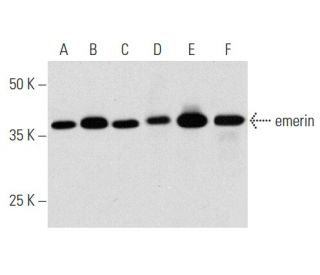

emerin Antikörper (A-5): sc-515522
- emerin Antikörper (A-5) ist ein Maus monoklonales IgG1 (kappa light chain) in einer Menge von 200 µg/ml
- spezifisch für ein Epitop, welches zwischen den Aminosäuren 2-28 in der Nähe des N-terminus von emerin aus der Spezies human liegt
- Empfohlen für die Detektion von emerin aus der Spezies human per WB, IP, IF und ELISA
- m-IgG Fc BP-HRP und m-IgG1 BP-HRP sind die bevorzugten sekundären Nachweisreagenzien für emerin Antikörper (A-5) for WB applications. Diese Reagenzien werden jetzt in Bündeln mit emerin Antikörper (A-5) angeboten(siehe Bestellinformationen unten).
Emerin-Antikörper (A-5) ist ein monoklonaler IgG1-Antikörper der Maus, der Emerin in menschlichen Proben durch Anwendungen wie Western Blot (WB), Immunpräzipitation (IP), Immunfluoreszenz (IF) und Enzyme-linked Immunosorbent Assay (ELISA) nachweist. Emerin ist ein entscheidender Bestandteil der Kernlamina und spielt eine wichtige Rolle bei der Aufrechterhaltung der strukturellen Integrität der Kernhülle und der Erleichterung der Chromatinorganisation. Die Lokalisierung von Emerin an der Kernmembran ist für die ordnungsgemäße Funktion des Kerns von entscheidender Bedeutung, da Emerin dazu beiträgt, die Kernlamina an der inneren Kernmembran zu verankern und so die Genexpression und die zellulären Signalwege zu beeinflussen. Mutationen im Gen, das für Emerin kodiert, können zur X-chromosomal-rezessiven Erkrankung Emery-Dreyfuss-Muskeldystrophie (EDMD) führen, die sich in fortschreitender Muskelschwäche, Kontrakturen und Herzproblemen äußert. Das Fehlen von Emerin stört die normale Verbindung zwischen der Kernmembran und der Lamina und trägt zur Pathophysiologie von EDMD bei. Die spezifische Lokalisation von Emerin in Desmosomen und Fasciae adherentes im Herzgewebe könnte die bei betroffenen Patienten beobachteten Reizleitungsstörungen erklären und die entscheidende Rolle von Emerin für die Gesundheit von Muskeln und Herz unterstreichen.
Alexa Fluor® ist ein Markenzeichen von Molecular Probes Inc., OR., USA
LI-COR® und Odyssey® sind Markenzeichen von LI-COR Biosciences
emerin Antikörper (A-5) Literaturhinweise:
- Intrazellulärer Transport von Emerin, dem Protein der Emery-Dreifuss-Muskeldystrophie. | Ostlund, C., et al. 1999. J Cell Sci. 112 (Pt 11): 1709-19. PMID: 10318763
- BAF ist für den Einbau von Emerin in die sich neu bildende Kernhülle erforderlich. | Haraguchi, T., et al. 2001. J Cell Sci. 114: 4575-85. PMID: 11792822
- Die Assoziation von Emerin mit nukleärem und zytoplasmatischem Aktin wird in sich differenzierenden Myoblasten reguliert. | Lattanzi, G., et al. 2003. Biochem Biophys Res Commun. 303: 764-70. PMID: 12670476
- Emerin bedeckt das spitze Ende der Aktinfilamente: Nachweis eines kortikalen Aktinnetzwerks an der inneren Kernmembran. | Holaska, JM., et al. 2004. PLoS Biol. 2: E231. PMID: 15328537
- Das innerkernige Hüllprotein Emerin reguliert die HIV-1-Infektiosität. | Jacque, JM. and Stevenson, M. 2006. Nature. 441: 641-5. PMID: 16680152
- Das mit der Emery-Dreifuss-Muskeldystrophie assoziierte Protein Emerin wird durch die Proteinkinase A an Serin 49 phosphoryliert. | Roberts, RC., et al. 2006. FEBS J. 273: 4562-75. PMID: 16972941
- Tyrosinphosphorylierung des Kernmembranproteins Emerin durch Src, Abl und andere Kinasen. | Tifft, KE., et al. 2009. J Cell Sci. 122: 3780-90. PMID: 19789182
- Partieller Mangel an Emerin, verursacht durch eine Spleißstellenmutation in EMD. | Yuan, J., et al. 2014. Intern Med. 53: 1563-8. PMID: 25030574
- Mutationen bei der Emery-Dreifuss-Muskeldystrophie und ihre Auswirkungen auf die Emerin-Proteinexpression. | Manilal, S., et al. 1998. Hum Mol Genet. 7: 855-64. PMID: 9536090
- Kolokalisierung von Emerin und Lamin in Interphase-Kernen und Veränderungen während der Mitose. | Manilal, S., et al. 1998. Biochem Biophys Res Commun. 249: 643-7. PMID: 9731189
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
emerin Antikörper (A-5) | sc-515522 | 200 µg/ml | $322.00 | |||
emerin (A-5): m-IgG Fc BP-HRP Bundle | sc-541063 | 200 µg Ab; 10 µg BP | $361.00 | |||
emerin (A-5): m-IgG1 BP-HRP Bundle | sc-542558 | 200 µg Ab; 20 µg BP | $361.00 | |||
emerin (A-5) Neutralizing Peptid | sc-515522 P | 100 µg/0.5 ml | $69.00 |

