
ACYP2 Antikörper (G-5): sc-398251
- ACYP2 Antikörper (G-5) ist ein Maus monoklonales IgG1 κ, verwendet in 1 wissenschaftlichen Veröffentlichungen, in einer Menge von 200 µg/ml
- gezogen gegen die Aminosäuresequenz 1-99 entsprechend dem Volllängeprotein ACYP2 aus der Spezies human
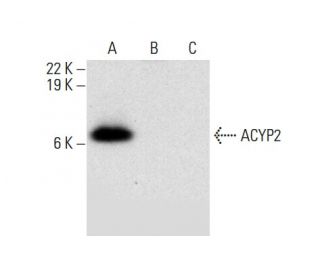
- Empfohlen für die Detektion von muscle ACYP2 aus der Spezies human per WB, IP, IF und ELISA
- m-IgG Fc BP-HRP, 1 BP-HRP">m-IgG1 BP-HRP und m-IgGκ BP-HRP sind die bevorzugten sekundären Nachweisreagenzien für ACYP2 Antikörper (G-5) für WB-Anwendungen. Diese Reagenzien werden jetzt in Bündeln mit ACYP2 Antikörper (G-5) angeboten(siehe Bestellinformationen unten).
Direktverknüpfungen
Die Bildung stabiler, hoch organisierter Proteinaggregate, bekannt als Amyloidfibrillen, ist mit mehreren schwerwiegenden menschlichen Erkrankungen verbunden, darunter Alzheimer-Krankheit, Parkinson-Krankheit und Creutzfeldt-Jakob-Krankheit (1,2). Bei jeder dieser Erkrankungen sammelt sich ein normalerweise lösliches Peptid oder Protein in unlösliche Fibrillen an (1,2). Die Muskelacylphosphatase (AcP) hat sich als wichtiges Modellsystem zur Untersuchung der Proteinfehlfaltung und Aggregation erwiesen (1,3-6). Sie ist besonders geeignet für diese Studien, da die Muskel-AcP ein kleines, einfaches Protein aus nur 98 Aminosäuren besteht, das aus einem fünfsträngigen antiparallelen b-Blatt und zwei parallelen a-Helices besteht. Mutationen in der Muskel-AcP zwischen den Resten 16-31 und 87-98, die ihre Phosphatbindungsstelle bei Arg-23 enthalten, erhöhen die Aggregationsrate erheblich (1,6). Diese Mutationen korrelieren mit Veränderungen der Hydrophobizität von AcP und einer Konversion der a-Helices in b-Blätter. Daher kann eine Reduktion der Netto-Ladung eines Proteins ein entscheidender Faktor für einige Formen von Proteinablagerungserkrankungen sein.
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
ACYP2 Antikörper (G-5) | sc-398251 | 200 µg/ml | $322.00 | |||
ACYP2 (G-5): m-IgG Fc BP-HRP Bundle | sc-538406 | 200 µg Ab; 10 µg BP | $361.00 | |||
ACYP2 (G-5): m-IgGκ BP-HRP Bundle | sc-536015 | 200 µg Ab; 40 µg BP | $361.00 | |||
ACYP2 (G-5): m-IgG1 BP-HRP Bundle | sc-545687 | 200 µg Ab; 20 µg BP | $361.00 |

