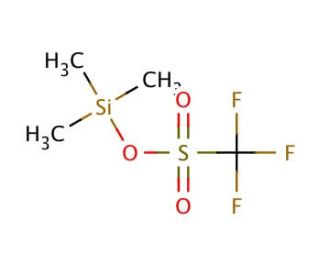
Trimethylsilyl trifluoromethanesulfonate (CAS 27607-77-8)
ACCÈS RAPIDE AUX LIENS
Le trifluorométhanesulfonate de triméthylsilyle est un acide de Lewis fort qui fonctionne comme un catalyseur très efficace dans diverses réactions chimiques. Il agit comme une source d'anion trifluorométhanesulfonate, qui peut être utilisé pour activer les substrats en vue d'une attaque nucléophile. Cette activation facilite la formation de liaisons carbone-carbone et carbone-hétéroatome dans la synthèse organique. Le mode d'action implique l'activation des électrophiles par coordination avec l'anion trifluorométhanesulfonate, ce qui entraîne une réactivité et une sélectivité accrues dans les transformations chimiques souhaitées. Il sert de promoteur pour l'activation des composés contenant du silicium, ce qui permet de générer des intermédiaires réactifs pour d'autres applications. Ainsi, le trifluorométhanesulfonate de triméthylsilyle joue un rôle en facilitant la formation efficace et sélective de molécules organiques complexes dans la recherche et le développement.
Trimethylsilyl trifluoromethanesulfonate (CAS 27607-77-8) Références
- Formation d'énol-silane en une seule étape - alkylation de cétones avec des carboxylates de propargyle favorisée par le trifluorométhanesulfonate de triméthylsilyle. | Downey, CW., et al. 2018. J Org Chem. 83: 12931-12938. PMID: 30248260
- α-Arylation formelle de l'énone par migration/élimination d'aryles médiée par l'I(III). | Martins, BS., et al. 2021. Org Lett. 23: 2094-2098. PMID: 33635665
- Addition de Friedel-Crafts d'indoles à des nitrones favorisée par le trifluorométhanesulfonate de triméthylsilyle. | Oracheff, ZZ., et al. 2021. J Org Chem. 86: 17328-17336. PMID: 34780184
- Isomérisation d'oléfines contre-thermodynamique par hydroboration et déshydroboration en chaîne. | Hanna, S., et al. 2022. Org Lett. 24: 1005-1010. PMID: 35080409
- Préparation de réactifs I(III) ligaturés à l'azote (bis)cationique: Synthèse de [(pyridine)2IPh](OTf)2 et [(4-CF3-pyridine)2IPh](OTf)2. | Hoblos, B. and Wengryniuk, SE. 2021. Organic Synth. 98: 391-406. PMID: 35949486
- Synthèse de styrènes β,β-disubstitués via le couplage aldol-élimination promu par le triméthylsilyl trifluorométhanesulfonate. | Dixon, GJ., et al. 2022. J Org Chem. 87: 14846-14854. PMID: 36239694
- Synthèses totales énantiosélectives de préussomérines: Contrôle de la stéréogénicité du spiroacétal par réaction photochimique d'une naphtoquinone par transfert d'atomes d'hydrogène 1,6. | Ando, Y., et al. 2023. Angew Chem Int Ed Engl. 62: e202213682. PMID: 36446739
- Nucléosides puriques substitués par l'adamantane: Synthèse, complexes hôte-invité avec la β-Cyclodextrine et activité biologique. | Rudolfová, J., et al. 2022. Int J Mol Sci. 23: PMID: 36499470
- Conception et synthèse de Fondaparinux neutralisable. | Zhang, L., et al. 2022. JACS Au. 2: 2791-2799. PMID: 36590263
- Carbosilylation régio- et stéréosélective de Ynamides avec des triméthylsilanes allyliques catalysée par le Silylium. | Yepes, P., et al. 2023. Org Lett. 25: 1020-1024. PMID: 36749888
- Conception et synthèse de nouvelles bases puriques flexibles modifiées en tant qu'inhibiteurs potentiels de la PNP humaine. | Khandazhinskaya, A., et al. 2023. Molecules. 28: PMID: 36770593
- Synthèse en flux continu du Δ9-Tétrahydrocannabinol et du Δ8-Tétrahydrocannabinol à partir du cannabidiol. | Bassetti, B., et al. 2023. J Org Chem. 88: 6227-6231. PMID: 37014222
- Une stratégie convergente de couplage de fragments pour accéder aux centres stéréogéniques quaternaires. | Kerkovius, JK., et al. 2023. Chem Sci. 14: 4397-4400. PMID: 37123185
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Trimethylsilyl trifluoromethanesulfonate, 25 g | sc-255700 | 25 g | $47.00 | |||
Trimethylsilyl trifluoromethanesulfonate, 50 g | sc-255700A | 50 g | $164.00 |
