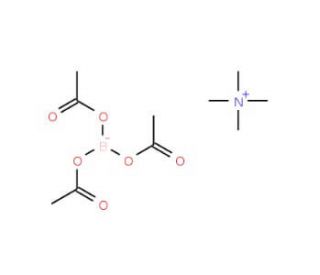
Tetramethylammonium triacetoxyborohydride (CAS 109704-53-2)
ACCÈS RAPIDE AUX LIENS
Le triacétoxyborohydrure de tétraméthylammonium (TMAB) est un composé organique puissant largement utilisé dans le domaine de la chimie organique synthétique. Il sert d'agent réducteur robuste, principalement utilisé pour convertir les aldéhydes et les cétones en leurs alcools respectifs. Au-delà de ce rôle, le triacétoxyborhydrure de tétraméthylammonium joue un rôle essentiel dans la construction de diverses molécules organiques telles que les amines, les esters et les amides. En chimie organique synthétique, l'utilisation généralisée du triacétoxyborohydrure de tétraméthylammonium est remarquable. Son utilisation englobe la création d'une myriade d'entités organiques, allant des amines, esters et amides aux polymères, en passant par les colorants. La capacité du triacétoxyborhydrure de tétraméthylammonium en tant qu'agent réducteur puissant est indubitable, en particulier dans sa capacité à transformer les aldéhydes et les cétones en alcools correspondants. Le mécanisme sous-jacent de cette transformation implique le transfert orchestré d'électrons de l'atome de bore à la fraction carbonyle de l'aldéhyde ou de la cétone, aboutissant à la réduction du groupe carbonyle en alcool.
Tetramethylammonium triacetoxyborohydride (CAS 109704-53-2) Références
- Études synthétiques sur le (-)-FR901483 utilisant une allylation conjuguée pour installer le carbone quaternaire en C-1. | Gotchev, DB. and Comins, DL. 2006. J Org Chem. 71: 9393-402. PMID: 17137366
- Synthèses économiques et stéréosélectives des sous-unités des anneaux a et B des bryostatines. | Trost, BM., et al. 2011. Chemistry. 17: 9777-88. PMID: 21774000
- Développement de voies synthétiques énantiosélectives pour la (-)-kinamycine F et l'aglycone de (-)-lomaiviticine. | Woo, CM., et al. 2012. J Am Chem Soc. 134: 17262-73. PMID: 23030272
- Stéréocontrôle dans les substitutions propargyliques catalysées par le palladium: Résolution cinétique pour donner des 1,5-énynes et des acétates de propargyle enrichis enantioen. | Ardolino, MJ., et al. 2013. Adv Synth Catal. 355: 3413-3419. PMID: 24839434
- Activité diacyltransférase et spécificité de longueur de chaîne de Mycobacterium tuberculosis PapA5 dans la synthèse de lipides alkyl β-Diol. | Touchette, MH., et al. 2015. Biochemistry. 54: 5457-68. PMID: 26271001
- Synthèse d'un analogue triazole simplifié de la pateamine A. | Hemi Cumming, A., et al. 2016. Org Biomol Chem. 14: 5117-27. PMID: 27180995
- Identification de nouveaux inhibiteurs de l'acétylcholinestérase conçus par criblage virtuel basé sur la pharmacopée, l'amarrage moléculaire et les essais biologiques. | Jang, C., et al. 2018. Sci Rep. 8: 14921. PMID: 30297729
- Activités cellulaires supérieures des ligands azidés par rapport aux ligands aminés pour les riboswitches preQ1 dans E.coli. | Neuner, E., et al. 2018. RNA Biol. 15: 1376-1383. PMID: 30332908
- Synthèses totales des xiamycines A, C, F, H et de l'oridamycine A et évaluation préliminaire de leurs propriétés antifongiques. | Pfaffenbach, M., et al. 2019. Angew Chem Int Ed Engl. 58: 15304-15308. PMID: 31419367
- Synthèse facile des saikosaponines. | Wang, Z., et al. 2021. Molecules. 26: PMID: 33808330
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Tetramethylammonium triacetoxyborohydride, 10 g | sc-258237 | 10 g | $203.00 |
