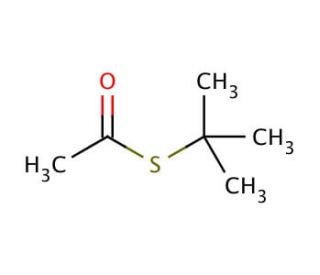
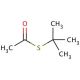
Structure moléculaire de S-tert-Butyl thioacetate, Numéro CAS: 999-90-6
S-tert-Butyl thioacetate (CAS 999-90-6)
Numéro CAS:
999-90-6
Masse Moléculaire:
132.22
Formule Moléculaire:
C6H12OS
Information supplémentaire:
Ce produit est classé comme marchandise dangereuse pour le transport et peut faire l'objet de frais d'expédition supplémentaires.
Pour la Recherche Uniquement. Non conforme pour le Diagnostic ou pour une Utilisation Thérapeutique.
* Consulter le Certificat d'Analyses pour les données spécifiques à un lot (incluant la teneur en eau).
ACCÈS RAPIDE AUX LIENS
Informations pour la commande
Description
Information Technique
Données de Sécurité
SDS & Certificat d’Analyses
Le S-tert-Butyl thioacetate, un composé thioester, a trouvé des applications précieuses dans divers domaines de la recherche scientifique. Sa nature polyvalente permet de l'utiliser pour synthétiser des composés bioactifs, créer des catalyseurs innovants et explorer les réactions catalysées par des enzymes. En outre, il joue un rôle crucial dans la synthèse de peptides et de peptidomimétiques, avec la génération d'autres petites molécules. Le thioacétate de S-tert-butyle est un réactif fiable pour la synthèse d'hétérocycles, y compris les thiophènes, les thiazoles et les thiolactones.
S-tert-Butyl thioacetate (CAS 999-90-6) Références
- Synthèse de l'antibiotique macrolide antifongique (+)-roxaticine. | Evans, DA. and Connell, BT. 2003. J Am Chem Soc. 125: 10899-905. PMID: 12952470
- Études synthétiques sur un antibiotique antitumoral, la bléomycine. XIV. Synthèse de l'acide Boc-pyrimidoblamique. | Otsuka, M., et al. 1985. Chem Pharm Bull (Tokyo). 33: 520-6. PMID: 2410153
- Affectation stéréochimique de l'inhibiteur d'interaction protéine-protéine JBIR-22 par synthèse totale. | Healy, AR., et al. 2015. Angew Chem Weinheim Bergstr Ger. 127: 4118-4122. PMID: 27087707
- Synthèse totale de l'antibiotique à large spectre amycolamicine. | Meguro, Y., et al. 2022. J Am Chem Soc. 144: 5253-5257. PMID: 35297637
- Réactions de Michael énantiosélectives catalysées par l'acide de Lewis de malonates d'alkylidène. Catalyse par des complexes de cuivre(II) bis(oxazoline) symétriques en C2 dans la synthèse d'esters de glutarate chiraux et différenciés | David A. Evans, Tomislav Rovis, Marisa C. Kozlowski, C. Wade Downey, and Jason S. Tedrow. 2000,. J. Am. Chem. Soc. 122, 38:, 9134–9142.
- Addition d'acétals de triméthylsilyle de cétène à des cétones.alpha,.beta.-insaturées: une nouvelle stratégie pour l'addition de Michael d'énolates d'esters | T. V. RajanBabu. 1984,. J. Org. Chem. 49, 12,: 2083–2089.
- Enolboration. 1. Dicyclohexylchloroborane/triéthylamine comme réactif pratique pour l'énolboration de cétones et d'autres dérivés carbonylés | Herbert C. Brown, Raj K. Dhar, Kumaraperumal Ganesan, and Bakthan Singaram. 1992.: J. Org. Chem., 57, 2,: 499–504.
- Synthèse chirale via les organoboranes. 33. Réaction contrôlée de B-alkyldiisopinocampheylboranes avec des aldéhydes fournissant une procédure pratique pour l'enrichissement énantiomérique des produits esters boroniques par résolution cinétique | https://pubs.acs.org/doi/abs/10.1021/jo00028a021. 1992. J. Org. Chem., 57, 2:, 504–511.
- La condensation S-Thioester Enolate/Imine: Un raccourci vers les β-lactames | and Maurizio Benaglia, Mauro Cinquini, Franco Cozzi. February 2000. European Journal of Organic Chemistry. Volume2000, Issue4: Pages 563-572.
- Réactions de Mannich énantiosélectives utilisant un nouveau catalyseur chiral au zirconium pour la synthèse de dérivés d'acides β-aminés optiquement actifs | Haruro Ishitani, Masaharu Ueno, and Shū Kobayashi. 2000,. J. Am. Chem. Soc. 122, 34,: 8180–8186.
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
S-tert-Butyl thioacetate, 1 g | sc-258095 | 1 g | $110.00 |
