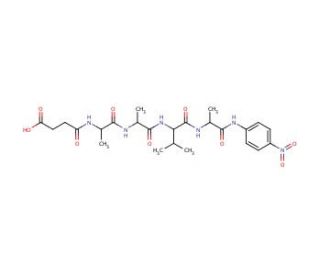
Structure moléculaire de N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide, Numéro CAS: 108322-03-8
N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide (CAS 108322-03-8)
Application(s):
N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide est un substrat enzymatique
Numéro CAS:
108322-03-8
Masse Moléculaire:
550.56
Formule Moléculaire:
C24H34N6O9
Pour la Recherche Uniquement. Non conforme pour le Diagnostic ou pour une Utilisation Thérapeutique.
* Consulter le Certificat d'Analyses pour les données spécifiques à un lot (incluant la teneur en eau).
ACCÈS RAPIDE AUX LIENS
Informations pour la commande
Description
Information Technique
Données de Sécurité
SDS & Certificat d’Analyses
Le p-nitroanilide N-Succinyl-Ala-Ala-Val-Ala joue un rôle crucial dans divers domaines de la recherche scientifique. Ses applications englobent l'étude des interactions protéine-protéine, la synthèse des protéines, l'inhibition des enzymes et les essais biochimiques. Ce substrat peptidique, le p-nitroanilide N-Succinyl-Ala-Ala-Val-Ala, facilite l'examen de l'activité enzymatique. En se liant au site actif de l'enzyme, il déclenche la conversion catalytique du substrat en produit. Le produit est ensuite libéré, ce qui permet à l'enzyme de revenir à son état initial.
N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide (CAS 108322-03-8) Références
- Purification et caractérisation d'une sérine protéase intracellulaire de type chymotrypsine de Thermoplasma volcanium. | Kocabiyik, S. and Ozdemir, I. 2006. Biosci Biotechnol Biochem. 70: 126-34. PMID: 16428830
- Spécificité du substrat et thermostabilité de la protéase alcaline de déshuilage de Bacillus pumilus. | Wan, MY., et al. 2009. Appl Biochem Biotechnol. 159: 394-403. PMID: 19132554
- Un nouvel alcaloïde isoquinoléine, inhibiteur de la DD-carboxypeptidase, avec une activité antibactérienne isolée de Streptomyces sp. 8812. Partie I: taxonomie, fermentation, isolement et activités biologiques. | Solecka, J., et al. 2009. J Antibiot (Tokyo). 62: 575-80. PMID: 19713994
- Les substitutions Gly ou Ala pour Pro(210)Thr(211)Asn(212) dans le tour β8-β9 de la subtilisine Carlsberg augmentent le taux catalytique et diminuent la thermostabilité. | Fuchita, N., et al. 2012. Biochim Biophys Acta. 1824: 620-6. PMID: 22326746
- Aperçu structurel et mécanistique de la dégradation du collagène par une sérine protéase collagénolytique bactérienne de la famille des subtilisines. | Ran, LY., et al. 2013. Mol Microbiol. 90: 997-1010. PMID: 24112706
- La tétramérisation induite par le calcium et la chélation du zinc protègent la calprotectine humaine de la dégradation par les protéases extracellulaires de l'hôte et des bactéries. | Stephan, JR. and Nolan, EM. 2016. Chem Sci. 7: 1962-1975. PMID: 26925211
- Caractérisation d'une nouvelle sérine protéase S8 de la bactérie marine sédimentaire Photobacterium sp. A5-7 et fonction de son domaine associé à la protéase. | Li, HJ., et al. 2016. Front Microbiol. 7: 2016. PMID: 28066343
- Structure cristalline d'une protéase active au froid (Pro21717) de la bactérie psychrophile Pseudoalteromonas arctica PAMC 21717, à une résolution de 1,4 Å: Adaptations structurelles au froid et analyse fonctionnelle d'une enzyme de détergent à lessive. | Park, HJ., et al. 2018. PLoS One. 13: e0191740. PMID: 29466378
- Protéase alcaline microbienne marine: Un outil efficace et essentiel pour diverses applications industrielles. | Barzkar, N. 2020. Int J Biol Macromol. 161: 1216-1229. PMID: 32534091
Substrat de:
Enzyme.Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
N-Succinyl-Ala-Ala-Val-Ala p-nitroanilide, 25 mg | sc-215479 | 25 mg | $151.00 |
