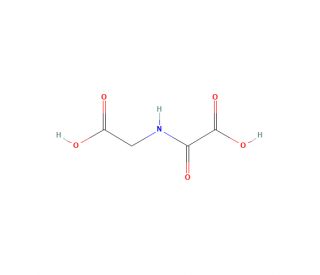
N-Oxalylglycine (CAS 5262-39-5)
Voir les citations produits (5)
ACCÈS RAPIDE AUX LIENS
La N-Oxalylglycine est un composé qui fonctionne comme un inhibiteur compétitif des dioxygénases dépendantes du 2-oxoglutarate. Il agit en chélatant le fer du site actif, empêchant ainsi la liaison du cosubstrat et inhibant l'activité enzymatique. Le mécanisme d'action de la N-Oxalylglycine consiste à perturber le cycle catalytique des dioxygénases dépendantes du 2-oxoglutarate, qui sont impliquées dans divers processus biologiques tels que la déméthylation de l'ADN et des histones, ainsi que dans les voies de réponse à l'hypoxie. En interférant avec l'activité enzymatique de ces dioxygénases, la N-Oxalylglycine peut être utilisée pour étudier les rôles spécifiques de ces enzymes dans les processus cellulaires et les voies de signalisation. Sa capacité à inhiber de manière compétitive le fer du site actif peut être utile pour étudier les mécanismes moléculaires qui sous-tendent les fonctions des dioxygénases dépendantes du 2-oxoglutarate dans diverses applications expérimentales.
N-Oxalylglycine (CAS 5262-39-5) Références
- Étude cinétique et spectroscopique de l'inhibition par le CoII, le NiII et la N-oxalylglycine de la dioxygénase FeII/alpha-cétoglutarate, TauD. | Kalliri, E., et al. 2005. Biochem Biophys Res Commun. 338: 191-7. PMID: 16165092
- Synthèse et activité de la N-oxalylglycine et de ses dérivés en tant qu'inhibiteurs de l'histone lysine déméthylase contenant le domaine C de Jumonji. | Hamada, S., et al. 2009. Bioorg Med Chem Lett. 19: 2852-5. PMID: 19359167
- Preuve de l'absence de suppression transcriptionnelle directe de l'hepcidine, peptide régulateur du fer, par les facteurs inductibles par l'hypoxie. | Volke, M., et al. 2009. PLoS One. 4: e7875. PMID: 19924283
- Conception de champ de force et simulations de dynamique moléculaire du facteur inhibiteur HIF-1 et de son complexe avec des inhibiteurs connus: implications pour la conception d'inhibiteurs rationnels. | Park, H., et al. 2010. J Mol Graph Model. 29: 221-8. PMID: 20663694
- La N-oxalylglycine, inhibiteur à large spectre de la 2-oxoglutarate oxygénase, est présente dans la rhubarbe et les feuilles d'épinard. | Al-Qahtani, K., et al. 2015. Phytochemistry. 117: 456-461. PMID: 26196940
- Nouvelle stratégie électrochimique sans étiquette pour la détermination sensible de la protéine 1 de translocation dix-sept. | Yu, Z., et al. 2021. Anal Chim Acta. 1146: 140-145. PMID: 33461709
- Une nouvelle série d'inhibiteurs putatifs de l'histone-déméthylase de Brugia malayi comme médicaments anti-filariens potentiels. | Kreiss, T., et al. 2022. PLoS Negl Trop Dis. 16: e0010216. PMID: 35294431
- Conservation du pli dimérique JmjC inhabituel de JMJD7 de Drosophila melanogaster à l'homme. | Chowdhury, R., et al. 2022. Sci Rep. 12: 6065. PMID: 35410347
- Correction de l'éditeur: Analogues du MOG pour explorer le pharmacophore du MCT2, biologie de l'α-cétoglutarate et effets cellulaires de la N-oxalylglycine. | Fets, L., et al. 2022. Commun Biol. 5: 1019. PMID: 36167803
- Analyse structurale du site de liaison du 2-oxoglutarate de l'oxygénase JMJD5 liée au rythme circadien. | Islam, MS., et al. 2022. Sci Rep. 12: 20680. PMID: 36450832
- Un criblage à haut débit des effecteurs identifie un nouvel échafaudage de petites molécules pour l'inhibition de la dioxygénase 2 à translocation dix-sept. | Palei, S., et al. 2022. RSC Med Chem. 13: 1540-1548. PMID: 36545435
- Le formaldéhyde réagit avec les résidus de proline N-terminaux pour donner des aminaux bicycliques. | John, T., et al. 2023. Commun Chem. 6: 12. PMID: 36698022
- Sélectivité du substrat et inhibition des histidine JmjC hydroxylases MINA53 et NO66. | Türkmen, VA., et al. 2023. RSC Chem Biol. 4: 235-243. PMID: 36908702
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
N-Oxalylglycine, 10 mg | sc-202720 | 10 mg | $53.00 | |||
N-Oxalylglycine, 100 mg | sc-202720A | 100 mg | $153.00 |
