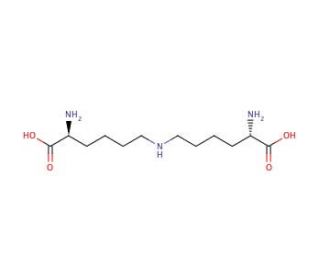
Lysinonorleucine (CAS 25612-46-8)
Voir les citations produits (2)
ACCÈS RAPIDE AUX LIENS
La lysinonorleucine est un dipeptide avec une application dans la recherche biochimique en raison de son rôle de biomarqueur pour les dommages aux protéines, en particulier dans l'étude de la réticulation et de la dégradation des protéines. Il est utilisé pour évaluer l'ampleur de l'oxydation des protéines et des événements de réticulation dans diverses conditions expérimentales, y compris les études sur le stress oxydatif et le vieillissement dans les systèmes cellulaires et tissulaires. La présence de lysinonorleucine dans les protéines indique la présence de produits finaux de glycation avancée (AGE), que les chercheurs analysent pour comprendre le processus de vieillissement et les effets à long terme de l'hyperglycémie dans les systèmes biologiques. En outre, la lysinonorleucine est impliquée dans l'élucidation des voies liées au renouvellement des protéines et aux modifications post-traductionnelles, ce qui permet de mieux comprendre les mécanismes cellulaires de maintien de l'intégrité des protéines. Sa quantification est également essentielle dans le domaine de la protéomique, où elle contribue à la caractérisation de mélanges complexes de protéines et à l'identification de nouvelles interactions protéine-protéine.
Lysinonorleucine (CAS 25612-46-8) Références
- Effet de l'hyper- et de la microgravité sur les contrôles post-traductionnels du collagène des ostéoblastes MC3T3-E1. | Saito, M., et al. 2003. J Bone Miner Res. 18: 1695-705. PMID: 12968680
- Différences liées à l'intensité dans les modifications post-traductionnelles du collagène dans les ostéoblastes MC3T3-E1 après exposition à des ultrasons pulsés de faible et de haute intensité. | Saito, M., et al. 2004. Bone. 35: 644-55. PMID: 15336600
- Un système modèle à deux composants pour étudier l'architecture de l'assemblage de l'élastine in vitro. | Mithieux, SM., et al. 2005. J Struct Biol. 149: 282-9. PMID: 15721582
- Diminution du degré de minéralisation et des liaisons enzymatiques du collagène et augmentation de la pentosidine induite par la glycation dans le cortex du col du fémur en cas de fracture du col du fémur. | Saito, M., et al. 2006. Osteoporos Int. 17: 986-95. PMID: 16552468
- Rôle des réticulations enzymatiques et induites par la glycation du collagène comme déterminant de la qualité osseuse chez les rats WBN/Kob spontanément diabétiques. | Saito, M., et al. 2006. Osteoporos Int. 17: 1514-23. PMID: 16770520
- Elastine et protéine associée à l'élastine de l'aorte et du poumon de porc. | Richmond, VL. 1990. Connect Tissue Res. 25: 131-7. PMID: 2175693
- Synthèse des liaisons transversales du collagène dans l'endothélium vasculaire cultivé. | Levene, CI., et al. 1989. Br J Exp Pathol. 70: 621-6. PMID: 2605112
- Évaluation de la réticulation dérivée de la Lysyl Oxidase dans le kératocône par chromatographie liquide/spectrométrie de masse. | Takaoka, A., et al. 2016. Invest Ophthalmol Vis Sci. 57: 126-36. PMID: 26780316
- L'élastine est réticulée de manière hétérogène. | Schräder, CU., et al. 2018. J Biol Chem. 293: 15107-15119. PMID: 30108173
- Les modifications de l'allysine perturbent la structure et la mobilité de la tropoélastine à l'échelle locale et globale. | Ozsvar, J., et al. 2019. Matrix Biol Plus. 2: 100002. PMID: 33543005
- Des nucléosides et des acides aminés, isolés à partir de Cordyceps sinensis, protègent contre la myélosuppression induite par le cyclophosphamide chez les souris. | Zhang, Y., et al. 2022. Nat Prod Res. 36: 6056-6059. PMID: 35188001
- Digestion à l'élastase et analyse biochimique de l'élastine d'un élastofibrome. | Nakamura, Y., et al. 1986. Cancer. 58: 1070-5. PMID: 3637115
- Synthèse de la lysinonorleucine et analyse par spectrométrie de masse de la lysinonorleucine et de la merodesmosine dans le ligament bovin et la membrane de la coquille d'œuf. | Oishi, K., et al. 2023. Arch Biochem Biophys. 740: 109585. PMID: 37001748
- L'histone H1 est un substrat de la lysyl-oxydase et contient des résidus endogènes réductibles au borotritide de sodium. | Kagan, HM., et al. 1983. Biochem Biophys Res Commun. 115: 186-92. PMID: 6137217
- Détection par chromatographie liquide à haute performance et fluorescence sur une seule colonne des liaisons transversales immatures, matures et sénescentes du collagène. | Saito, M., et al. 1997. Anal Biochem. 253: 26-32. PMID: 9356137
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Lysinonorleucine, 5 mg | sc-207837 | 5 mg | $344.00 |
