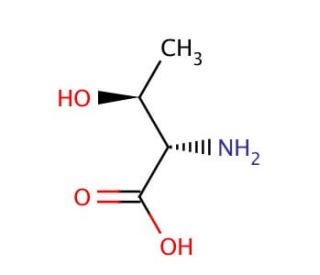
L-allo-Threonine (CAS 28954-12-3)
ACCÈS RAPIDE AUX LIENS
La L-allo-thréonine est un isomère de l'acide aminé thréonine, qui se distingue par l'arrangement de ses composants moléculaires, ce qui lui confère des propriétés uniques qui sont devenues un point central de la recherche en biochimie et en biologie structurale. Contrairement à son homologue, la L-thréonine, qui est incorporée dans les protéines pendant la traduction, la L-allo-thréonine ne se trouve pas dans les protéines et sert donc d'outil pour sonder la structure, la fonction et la stabilité des protéines. Les chercheurs utilisent la L-allo-thréonine dans l'étude de la spécificité des enzymes, en explorant la façon dont les enzymes distinguent des substrats étroitement liés. Cet isomère joue également un rôle essentiel en biologie synthétique, où il est utilisé pour concevoir de nouvelles protéines avec des séquences d'acides aminés modifiées, ce qui permet d'étudier les mécanismes de repliement des protéines et de concevoir des protéines dotées de nouvelles fonctions. En outre, les propriétés structurelles uniques de la L-allo-thréonine en font un composant précieux pour le développement de peptidomimétiques, des molécules qui imitent la structure des peptides et sont utilisées pour élucider les interactions au niveau moléculaire, ce qui permet de mieux comprendre les principes fondamentaux de la reconnaissance et de la liaison moléculaires.
L-allo-Threonine (CAS 28954-12-3) Références
- Structures à rayons X de complexes de thréonine aldolase: base structurelle de la reconnaissance du substrat. | Kielkopf, CL. and Burley, SK. 2002. Biochemistry. 41: 11711-20. PMID: 12269813
- Caractérisation des homologues de la déshydrogénase/réductase à chaîne courte d'Escherichia coli (YdfG) et de Saccharomyces cerevisiae (YMR226C). | Fujisawa, H., et al. 2003. Biochim Biophys Acta. 1645: 89-94. PMID: 12535615
- Vers une synthèse asymétrique préparative des acides aminés bêta-hydroxy-alpha: Formation de L-allo-thréonine à partir de glycine et d'acétaldéhyde à l'aide de GlyA recombinant. | Makart, S., et al. 2007. J Biotechnol. 130: 402-10. PMID: 17597243
- Évaluation du métabolisme de la thréonine in vivo par chromatographie en phase gazeuse/spectrométrie de masse et perfusion d'isotopes stables. | Ballèvre, O., et al. 1991. Anal Biochem. 193: 212-9. PMID: 1908193
- Découverte et caractérisation de la D-phénylsérine désaminase de l'Arthrobacter sp. TKS1. | Muramatsu, H., et al. 2011. Appl Microbiol Biotechnol. 90: 159-72. PMID: 21190106
- Atténuation des symptômes liés à l'asthme par un dérivé de la L-allo thréonine. | Heo, JC. and Lee, SH. 2013. Int J Mol Med. 31: 881-7. PMID: 23381610
- Arg-265: un résidu critique de la SHMT cytosolique de L.donovani dans le maintien de la liaison du THF et de la catalyse. | Gandhi, S., et al. 2015. Exp Parasitol. 149: 16-23. PMID: 25499510
- Rôle important du groupe hydroxyle sur l'adaptabilité conformationnelle du Bis(l-thréoninato)cuivre(II) par rapport au Bis(l-allo-thréoninato)cuivre(II): Étude de chimie quantique. | Marković, M., et al. 2016. Inorg Chem. 55: 7694-708. PMID: 27442350
- Effet du nouveau composé LX519290, un dérivé de la l-allo-thréonine, sur le potentiel antioxydant in vitro et in vivo. | Chun, K., et al. 2016. Int J Mol Sci. 17: PMID: 27598126
- La L-Thréonine et son analogue ajoutés à un milieu solide autoclavé suppriment la production de trichothécène par Fusarium graminearum. | Maeda, K., et al. 2017. Arch Microbiol. 199: 945-952. PMID: 28357472
- Biosynthèse de la cyclochlorotine: Identification des gènes impliqués dans les transformations oxydatives et la transacylation O,N intramoléculaire. | Jiang, Y., et al. 2021. Org Lett. 23: 2616-2620. PMID: 33736433
- Étude par spectroscopie térahertz des stéréoisomères de la thréonine. | Zeng, R., et al. 2022. Appl Spectrosc. 76: 1132-1141. PMID: 35469427
- Interactions entre les ions cuivre (II) et la L-thréonine, la L-allo-thréonine et la L-sérine en solution aqueuse. | Grenouillet, P., et al. 1973. Biochim Biophys Acta. 322: 185-94. PMID: 4765086
- Globomycine, un nouvel antibiotique peptidique avec une activité de formation de sphéroplastes. III. Détermination de la structure de la globomycine. | Nakajima, M., et al. 1978. J Antibiot (Tokyo). 31: 426-32. PMID: 670085
- Clonage du gène, caractérisation biochimique et rôle physiologique d'une L-thréonine aldolase thermostable de faible spécificité d'Escherichia coli. | Liu, JQ., et al. 1998. Eur J Biochem. 255: 220-6. PMID: 9692922
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
L-allo-Threonine, 250 mg | sc-255235 | 250 mg | $275.00 |
