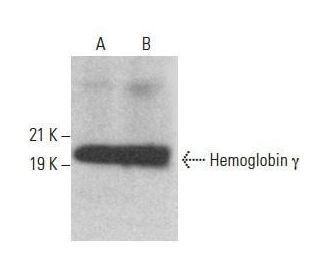

Anticorps Hemoglobin γ (B-4): sc-377395
- L'anticorps Hemoglobin gamma B-4 est un monoclonal IgG3 de souris fourni en 200 µg/ml
- spécifique d'un épitope situé entre les acides aminés 9-43 près de N-terminus de Hemoglobin γ d'origine human
- recommandé pour la détection de Hemoglobin γ d'origine human par WB, IP, IF et ELISA
- Voir Hemoglobin β/γ/δ/ε (A-8): sc-390668 pour d'autres anticorps conjugués Hemoglobin γ, dont AC, HRP, FITC, PE, Alexa Fluor® 488, 594, 647, 680 et 790.
- Nous testons actuellement encore nos anticorps secondaires pour trouver la meilleure protéine de liaison pour cet anticorps primaire Hemoglobin γ (B-4). Veuillez nous contacter si vous avez des questions concernant les réactifs de détection secondaire appropriés.
ACCÈS RAPIDE AUX LIENS
VOIR ÉGALEMENT...
L'hémoglobine (Hgb) est couplée à quatre anneaux tétrapyrroles liés au fer et au méthène (hème). Les loci α (16p13.3 ; 5'-ζ-pseudoz-pseudo α2-pseudo α1-α2-α1-œ1-3') et β (11p15.5) déterminent la structure de base de l'hémoglobine. La partie globine de l'hémoglobine est constituée de deux chaînes α et de deux chaînes β disposées par paires et formant un tétramère. Chacune des quatre chaînes de globine s'associe de façon covalente avec un groupe hème. Les liaisons entre les chaînes α et β sont plus faibles qu'entre des chaînes de globine similaires, formant ainsi un plan de clivage important pour la fixation et la libération de l'oxygène. Une forte affinité pour l'oxygène se produit lors de la relaxation du plan de clivage α1-β2. Lorsque les deux interfaces α1-β2 sont étroitement liées, l'hémoglobine a une faible affinité pour l'oxygène. L'Hb A, qui contient deux chaînes α et deux chaînes β, représente 97 % de l'hémoglobine circulante totale. Les 3 % restants de l'hémoglobine circulante totale se composent de l'Hb A-2, qui comprend deux chaînes α plus deux chaînes δ, et de l'hémoglobine fœtale (Hb F), qui comprend deux chaînes α avec deux chaînes γ.
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Anticorps Hemoglobin γ (B-4) | sc-377395 | 200 µg/ml | $322.00 | |||
Hemoglobin γ (B-4) peptide neutralisant | sc-377395 P | 100 µg/0.5 ml | $69.00 |

