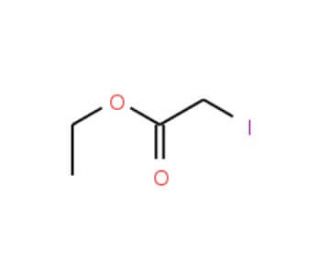
Ethyl iodoacetate (CAS 623-48-3)
ACCÈS RAPIDE AUX LIENS
L'iodoacétate d'éthyle est un composé chimique qui sert d'agent alkylant dans les applications de développement. Son mécanisme d'action implique l'alkylation des groupes thiols dans les protéines et les enzymes, ce qui conduit à l'inhibition de leur activité. L'iodoacétate d'éthyle est utilisé pour modifier et étudier la fonction de protéines et d'enzymes spécifiques dans des applications expérimentales. L'iodoacétate d'éthyle réagit avec les groupes thiols d'une variété de protéines, ce qui entraîne une perturbation de leur fonction normale. L'iodoacétate d'éthyle est particulièrement utile pour étudier le rôle de protéines spécifiques contenant des thiols dans les processus cellulaires. En modifiant de manière irréversible les groupes thiols, l'iodoacétate d'éthyle peut fournir des informations sur les mécanismes moléculaires qui sous-tendent diverses voies biologiques. Sa capacité à cibler sélectivement les protéines contenant des thiols peut être utile pour étudier la fonction d'enzymes et de protéines spécifiques en expérimentation. Le mécanisme d'action de l'iodoacétate d'éthyle au niveau moléculaire permet de manipuler et d'étudier avec précision les protéines contenant des thiols dans divers systèmes biologiques.
Ethyl iodoacetate (CAS 623-48-3) Références
- Effets de l'iodoacétate parentéral et d'autres réactifs thiols sur la rétine de Rabbi: relation entre les lésions histologiques et biochimiques. | NEWHOUSE, JP. and LUCAS, DR. 1959. Br J Ophthalmol. 43: 528-39. PMID: 14426801
- Addition de radicaux électrophiles et hétérocycliques centrés sur le carbone à des éthers d'oxime glyoxyliques. | McNabb, SB., et al. 2004. Org Lett. 6: 1911-4. PMID: 15176781
- Réaction catalytique énantiosélective de Reformatsky avec des cétones. | Fernández-Ibáñez, MA., et al. 2008. Chem Commun (Camb). 2571-3. PMID: 18506247
- Réaction catalytique énantiosélective de Reformatsky avec des diarylcétones ortho-substituées. | Fernández-Ibáñez, MA., et al. 2008. Org Lett. 10: 4041-4. PMID: 18715009
- Toxicité des mélanges d'électrophiles mous réactifs au S(N)2: 2-évaluation des mélanges contenant des acétates éthyliques α-halogénés. | Dawson, DA., et al. 2011. Arch Environ Contam Toxicol. 61: 547-57. PMID: 21452006
- Réaction de Reformatsky énantiosélective catalysée par une bisoxazolidine. | Wolf, C. and Moskowitz, M. 2011. J Org Chem. 76: 6372-6. PMID: 21623640
- Réactions de composés propargyles contenant un groupe cyclobutyle induites par un complexe de ruthénium. | Wang, YC., et al. 2012. Chem Asian J. 7: 2703-10. PMID: 22933365
- Synthèse d'un leucomitosane via une cascade de radicaux diastéréosélective. | Brucelle, F. and Renaud, P. 2013. J Org Chem. 78: 6245-52. PMID: 23721078
- Réactions de couplage à trois composants d'arynes pour la synthèse de benzofuranes et de coumarines. | Yoshioka, E., et al. 2014. Molecules. 19: 863-80. PMID: 24419139
- Réaction catalytique énantiosélective d'Aza-Reformatsky avec des amines cycliques. | De Munck, L., et al. 2016. Chemistry. 22: 17590-17594. PMID: 27775191
- Nouvelles coumarines substituées en 6 et 7 ayant une action inhibitrice sur la lipoxygénase et l'anhydrase carbonique IX associée aux tumeurs. | Peperidou, A., et al. 2018. Molecules. 23: PMID: 29329232
- Préparation d'acides 16-fluorohexadécanoïque et fluoroacétique marqués au fluor 18 sans ajout de porteur à partir de fluorure de tétraéthylammonium hautement réactif. | Bosch, AL., et al. 1986. Int J Rad Appl Instrum A. 37: 305-8. PMID: 3021654
- Réaction de Reformatsky hautement catalytique et énantiosélective avec des aldéhydes et des cétones en utilisant un ligand Prolinol disponible. | Ouyang, L., et al. 2020. ACS Omega. 5: 16967-16975. PMID: 32685867
- N-(cyanométhyl)- et N-(2-méthoxy-1-cyanoéthyl)anthracyclines et dérivés carboxylés apparentés. | Acton, EM., et al. 1986. J Med Chem. 29: 2074-9. PMID: 3761325
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Ethyl iodoacetate, 5 g | sc-239931 | 5 g | $31.00 |
