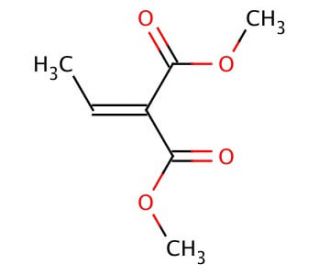
Structure moléculaire de Dimethyl ethylidenemalonate, Numéro CAS: 17041-60-0
Dimethyl ethylidenemalonate (CAS 17041-60-0)
Numéro CAS:
17041-60-0
Masse Moléculaire:
158.15
Formule Moléculaire:
C7H10O4
Pour la Recherche Uniquement. Non conforme pour le Diagnostic ou pour une Utilisation Thérapeutique.
* Consulter le Certificat d'Analyses pour les données spécifiques à un lot (incluant la teneur en eau).
ACCÈS RAPIDE AUX LIENS
Informations pour la commande
Description
Information Technique
Données de Sécurité
SDS & Certificat d’Analyses
Le diméthyl éthylidenemalonate (DME) est un composé synthétique largement utilisé en laboratoire comme réactif de synthèse et comme catalyseur dans les réactions organiques. Le mécanisme d'action du diméthyl éthylidenemalonate est centré sur sa fonction d'inhibiteur de l'enzyme phosphorylase kinase, qui joue un rôle important dans la régulation de la croissance cellulaire. En se liant à l'enzyme, le diméthyl éthylidenemalonate entrave efficacement son activité catalytique, empêchant ainsi la phosphorylation des protéines. La phosphorylation étant essentielle à la croissance et à la division cellulaires, cette inhibition a un effet dissuasif sur la prolifération cellulaire.
Dimethyl ethylidenemalonate (CAS 17041-60-0) Références
- Nouvelle synthèse de diènes conjugués attachés à un centre de carbone quaternaire via l'allylation déconjugative catalysée par le Pd(0) d'alcénylidenemalonates. | Sato, Y., et al. 2003. J Org Chem. 68: 9858-60. PMID: 14656125
- Réactions catalytiques asymétriques de Michael avec des énamides comme nucléophiles. | Berthiol, F., et al. 2007. Angew Chem Int Ed Engl. 46: 7803-5. PMID: 17768749
- Alkylation désoxygénique sélective d'alcools par fragmentation photocatalytique de radicaux domino. | Guo, HM. and Wu, X. 2021. Nat Commun. 12: 5365. PMID: 34508098
- Cycloaddition photochimique du trans-stilbène singulet avec des esters alpha, bêta-insaturés | Lewis, F. D., & DeVoe, R. J. 1980. The Journal of Organic Chemistry. 45(6): 948-951.
- Transformations photochimiques. 26. Photoréactions sensibilisées et non sensibilisées de quelques chlorures de benzyle dans l'alcool tert-butyle | Cristol, S. J., & Bindel, T. H. 1980. The Journal of Organic Chemistry. 45(6): 951-957.
- Synthèse photochimique de certains propellanes par cycloaddition [2+ 2] de l'indéno [2, 1-a] indène avec plusieurs oléfines | Shim, S. C., Chae, J. S., & Choi, J. H. 1983. The Journal of Organic Chemistry. 48(4): 417-421.
- Réaction de cycloaddition [3+ 2] catalysée par le palladium de vinylcyclopropanes avec des esters ou des cétones α, β-insaturés | Shimizu, I., Ohashi, Y., & Tsuji, J. 1985. Tetrahedron letters. 26(32): 3825-3828.
- Méthode efficace pour la synthèse de 5-carbométhoxypyrimidin-6-ones 1,4-disubstituées | Veale, C. A., Steelman, G. B., & Chow, M. M. 1993. The Journal of Organic Chemistry. 58(16): 4490-4493.
- Synthèse polyvalente de l'acridine-1, 9-diones | Chen, J., & Deady, L. W. 1997. Synthetic communications. 27(1): 95-106.
- Réactions de photocycloaddition du pyrazinopsoralène avec des oléfines simples | Han, G. S., & Shim, S. C. 1998. Photochemistry and photobiology. 67(1): 84-89.
- Réactions de formation de liaisons carbone-carbone des α-cyanocarbanions de métaux de transition liés à l'azote: une sonde mécaniste pour les réactions catalytiques de Michael des nitriles | Naota, T., Tannna, A., & Murahashi, S. I. 2001. Chem. Commun. (1): 63-64.
- Réaction de Michael catalytique énantiosélective de composés 1,3-dicarbonylés via la formation d'un énolate de palladium chiral | Hamashima, Y., Hotta, D., Umebayashi, N., Tsuchiya, Y., Suzuki, T., & Sodeoka, M. 2005. Advanced Synthesis & Catalysis. 347(11‐13): 1576-1586.
- Additions de Michael sélectives à des alkylidenemalonates à l'aide d'organocatalyseurs bifonctionnels à base de thiourée | Gavin, D. P., & Stephens, J. C. 2013. Arkivoc. 4: 76-87.
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Dimethyl ethylidenemalonate, 5 g | sc-227891 | 5 g | $112.00 |
