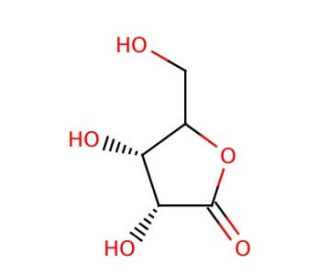
D-Ribonolactone (CAS 5336-08-3)
ACCÈS RAPIDE AUX LIENS
La D-Ribonolactone, un sucre lactone cyclique dérivé du ribose, s'est révélée être une molécule cruciale dans divers travaux de recherche, en particulier dans les domaines de la biochimie, de l'enzymologie et de la synthèse organique. Sa structure chimique, caractérisée par un anneau lactone à cinq chaînons, la rend propice à l'étude de la chimie des glucides et des transformations enzymatiques. En recherche, la D-Ribonolactone sert de substrat à des enzymes telles que les lactonases et les enzymes lactonisantes, qui catalysent son hydrolyse pour former du D-ribose, une molécule de sucre fondamentale impliquée dans de nombreux processus biologiques. Ce mécanisme d'hydrolyse enzymatique est largement étudié pour comprendre les interactions enzyme-substrat, les mécanismes catalytiques et la spécificité du substrat, ce qui permet de mieux comprendre la cinétique des enzymes et les stratégies d'ingénierie des protéines. En outre, la D-Ribonolactone est utilisée comme précurseur dans la synthèse de composés contenant du ribose, y compris les nucléosides, les nucléotides et les dérivés glucidiques, ce qui facilite le développement de nouvelles biomolécules ayant des applications potentielles dans la découverte de médicaments, la biologie moléculaire et la recherche en biologie chimique. Son rôle polyvalent en tant que matériau de départ dans la synthèse organique permet la construction de diverses chimiothèques et de sondes moléculaires pour l'étude des systèmes biologiques et le développement d'agents. Dans l'ensemble, la D-Ribonolactone reste un outil précieux pour la recherche scientifique, contribuant aux progrès de la chimie des glucides, de l'enzymologie et de la biologie synthétique.
D-Ribonolactone (CAS 5336-08-3) Références
- Découverte d'une petite molécule mimétique de l'insuline avec une activité antidiabétique chez la souris. | Zhang, B., et al. 1999. Science. 284: 974-7. PMID: 10320380
- Synthèse courte du 1,2:4,5-diepoxypentane énantiopur C2-symétrique et du 'pseudo'-C2-symétrique 3-azido-1,2:4,5-diepoxypentane à partir de l'arabitol. | Boydell, AJ., et al. 2003. J Org Chem. 68: 8252-5. PMID: 14535812
- Compensation des effets de matrice dans l'analyse par chromatographie en phase gazeuse et spectrométrie de masse de 186 pesticides dans des matrices de thé à l'aide de protecteurs d'analytes. | Li, Y., et al. 2012. J Chromatogr A. 1266: 131-42. PMID: 23102633
- Nucléosides. CXLVIII. Synthèse de 6-(bêta-D-ribofuranosyl)picolinamide. Un nouveau C-nucléoside à partir de D-ribonolactone. | Kabat, MM., et al. 1988. Chem Pharm Bull (Tokyo). 36: 634-40. PMID: 3136937
- Une analyse complète de 201 pesticides pour différentes espèces d'herbes - application prête à l'emploi utilisant la chromatographie en phase gazeuse couplée à la spectrométrie de masse en tandem avec QuEChERs. | Fu, Y., et al. 2019. J Chromatogr B Analyt Technol Biomed Life Sci. 1125: 121730. PMID: 31374421
- Injection sandwich et protecteurs d'analyte comme moyen de réduire la dérive due à l'effet de matrice entre l'étalonnage de bracketing en GC-MS/MS: une étude de cas. | Soliman, M. 2021. Talanta. 225: 121970. PMID: 33592804
- Synthèse verte du 1,5-didéoxy-1,5-imino-ribitol et du 1,5-didéoxy-1,5-imino-DL-arabinitol à partir de sucres D naturels sur des catalyseurs Au/Al2O3 et SO42-/Al2O3. | Gao, H. and Fan, A. 2021. Sci Rep. 11: 16928. PMID: 34413372
- Une entrée facile et générale aux phéromones et arômes optiquement actifs avec des structures γ-alkyl-γ-lactone. Étude de certains dérivés lactoniques des pentoses† | and J. Cardellach, J. Font, R. M. Ortuño.: March/April 1984. Journal of heterocyclic chemistry. Volume21, Issue2: Pages 327-331.
- Synthèses stéréocontrôlées de la 6-épi-trehazoline et de la 6-épi-trehalamine à partir de la D-ribonolactone | Masao Shiozaki, Masami Arai, Yoshiyuki Kobayashi, Atsushi Kasuya, Shuichi Miyamoto, Youji Furukawa, Tomoko Takayama, and Hideyuki Haruyama. 1994. J. Org. Chem. 59: 4450-4460.
- Synthèse concise, efficace et à l'échelle de production d'un dérivé protégé de la LL -Lyxonolactone protégé: Un important noyau d'aldonolactone | Hitesh Batra, Robert M. Moriarty, Raju Penmasta, Vijay Sharma, Gabriela Stanciuc, James P. Staszewski, and Sudersan M. Tuladhar, and David A. Walsh. 2006. Organic Process Research & Development. 10: 484−486.
- Synthèse efficace et hautement stéréocontrôlée d'α- et de β-pseudouridines | Stephen Hanessian* and Roger Machaalan. 3 November 2003. Tetrahedron Letters Issue 45. Volume 44: Pages 8321-8323.
- Approche basée sur la ribonolactone pour la synthèse de ribonucléosides de thymine substitués par du carbone 1′ | Hiroyuki Hayakawa, et al. 1994 - Issue 1-3. Nucleosides and Nucleotides. Volume 13,: 297-308.
- Synthèse de sucres à partir de D-Ribonolactone. II. Synthèse alternative du D-Erythrose | Ramesh H. Shah. Received 09 Sep 1985, Accepted 06 Dec 1985, Published online: 21 May 2008. Journal of Carbohydrate Chemistry. Volume 5, 1986 - Issue 1: Pages 139-146.
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
D-Ribonolactone, 5 g | sc-221517 | 5 g | $169.00 |
