Cytochalasin E, Aspergillus clavatus (CAS 36011-19-5)
Voir les citations produits (4)
ACCÈS RAPIDE AUX LIENS
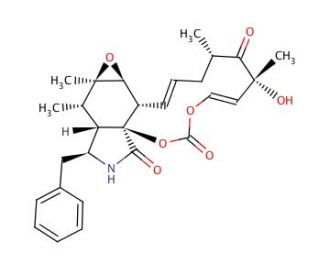
La cytochalasine E, un dérivé d'Aspergillus clavatus, fait partie de la classe des toxines fongiques cytochalasines, connues pour leur structure complexe, comprenant un anneau isoindole hydrogéné hautement substitué fusionné à un anneau macrocyclique. Ce composé est particulièrement utilisé dans la recherche pour explorer la polymérisation de l'actine et son impact sur la dynamique de l'actine. Il fonctionne en se liant à l'extrémité barbelée des filaments d'actine, ce qui bloque à la fois l'ajout et le retrait des sous-unités d'actine, perturbant ainsi la polymérisation de l'actine. Cette perturbation affecte de manière significative diverses activités cellulaires dépendant de l'actine, telles que le mouvement, la division et les processus d'internalisation. La cytochalasine E, Aspergillus clavatus, est un outil essentiel pour étudier les comportements complexes des filaments d'actine dans la signalisation cellulaire, le transport à l'intérieur des cellules et la réorganisation du cytosquelette, offrant ainsi des informations précieuses sur les processus cellulaires normaux et anormaux. Notamment, la Cytochalasine E, Aspergillus clavatus se distingue des autres Cytochalasines comme A et B, car elle n'interfère pas avec le transport des sucres à travers les membranes cellulaires, ce qui souligne son utilité spécifique dans l'étude des phénomènes liés à l'actine. La famille des cytochalasines, y compris des variantes comme les cytochalasines C, D, H et J, présente une gamme de composés pour une exploration scientifique détaillée, chacun avec ses attributs et effets uniques, facilitant un large spectre d'applications de recherche.
Cytochalasin E, Aspergillus clavatus (CAS 36011-19-5) Références
- La cytochalasine E, un métabolite fongique dérivé d'Aspergillus contenant un époxyde, inhibe l'angiogenèse et la croissance tumorale. | Udagawa, T., et al. 2000. J Pharmacol Exp Ther. 294: 421-7. PMID: 10900214
- Études comparatives de la résonance plasmonique de surface et de la rhéométrie à oscillation libre sur l'inhibition des plaquettes par la cytochalasine E et les anticorps monoclonaux dirigés contre la GPIIb/IIIa. | Hansson, KM., et al. 2002. Biosens Bioelectron. 17: 761-71. PMID: 12191924
- La dépolymérisation du filament d'actine par la cytochalasine E induit la production d'interleukine-8 et la régulation à la hausse de CD54 dans la lignée cellulaire épithéliale HeLa. | Ikewaki, N., et al. 2003. Microbiol Immunol. 47: 775-83. PMID: 14605444
- Caractérisation de l'Aspergillus sp. nov. F1 isolée d'une saline solaire marine en Chine. | Xiao, L., et al. 2013. World J Microbiol Biotechnol. 29: 11-7. PMID: 22910972
- La cytochalasine E modifie le cytosquelette et diminue l'activité ENaC dans les cellules Xenopus 2F3. | Reifenberger, MS., et al. 2014. Am J Physiol Renal Physiol. 307: F86-95. PMID: 24829507
- Oxygénases hautement sélectives mais multifonctionnelles dans le métabolisme secondaire. | Cochrane, RV. and Vederas, JC. 2014. Acc Chem Res. 47: 3148-61. PMID: 25250512
- Cytochalasine E dans le lichen acétabulaire Pleurosticta. Activité anti-proliférative contre les cellules cancéreuses colorectales humaines HT-29 et variabilité quantitative. | Delebassée, S., et al. 2017. Fitoterapia. 121: 146-151. PMID: 28705509
- Polymérisation de l'actine induite par un complexe de liaison à la cytochalasine de haute affinité lié à la motilité de la membrane des érythrocytes humains. | Lin, DC. and Lin, S. 1979. Proc Natl Acad Sci U S A. 76: 2345-9. PMID: 287078
- La cytochalasine E augmente la sensibilité des cellules du cancer du poumon humain A549 au bortézomib via l'inhibition de l'autophagie. | Takanezawa, Y., et al. 2018. Biochem Biophys Res Commun. 498: 603-608. PMID: 29524420
- La surexpression de la survivine a un effet négatif sur l'infection par le calicivirus félin. | Barrera-Vázquez, OS., et al. 2019. Viruses. 11: PMID: 31671627
- Effets de la cytochalasine et de la phalloïdine sur l'actine. | Cooper, JA. 1987. J Cell Biol. 105: 1473-8. PMID: 3312229
- Effets des cytochalasines sur les lymphocytes: quelques caractéristiques distinctives de la cytochalasine-E. | Mookerjee, BK. and Jung, CY. 1984. J Immunopharmacol. 6: 185-203. PMID: 6491312
- Inhibition de la polymérisation de l'actine dans les plaquettes sanguines par les cytochalasines. | Fox, JE. and Phillips, DR. 1981. Nature. 292: 650-2. PMID: 6894786
- Les cytochalasines bloquent l'élongation des filaments d'actine en se liant à des sites de haute affinité associés à la F-actine. | Flanagan, MD. and Lin, S. 1980. J Biol Chem. 255: 835-8. PMID: 7356663
- Production de patuline et de cytochalasine E par Aspergillus clavatus au cours du maltage de l'orge et du blé. | Lopez-Diaz, TM. and Flannigan, B. 1997. Int J Food Microbiol. 35: 129-36. PMID: 9105920
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Cytochalasin E, Aspergillus clavatus, 1 mg | sc-202561 | 1 mg | $169.00 |
