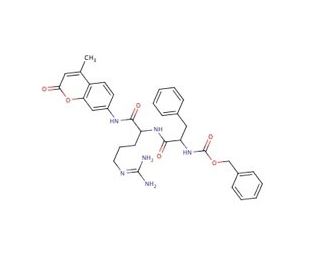
Cathepsin L substrate Substrat (CAS 65147-22-0)
Voir les citations produits (11)
ACCÈS RAPIDE AUX LIENS
Le substrat Cathepsin L est une molécule spécialisée conçue pour être utilisée dans des essais biochimiques afin d'étudier l'activité protéolytique de la Cathepsin L, une enzyme impliquée dans les processus de dégradation des protéines. En recherche, ces substrats sont essentiels pour élucider les mécanismes de dégradation et de renouvellement lysosomal, ainsi que pour comprendre la spécificité et la cinétique de l'enzyme. Les scientifiques utilisent des substrats marqués par fluorescence ou chromogène pour contrôler l'activité de la cathepsine L en temps réel, ce qui permet de mieux comprendre le rôle de cette enzyme dans les fonctions cellulaires normales et dans les conditions pathologiques associées à son dérèglement. En outre, ces substrats sont utilisés pour le criblage d'inhibiteurs potentiels capables de moduler l'activité de la cathepsine L, un domaine d'intérêt pour le développement de sondes chimiques utilisées pour disséquer des voies biologiques complexes. La conception et la synthèse de ces substrats intègrent souvent des séquences peptidiques reconnues et clivées par la cathepsine L, ce qui permet aux chercheurs d'étudier l'impact des modifications post-traductionnelles et le comportement de l'enzyme dans diverses conditions expérimentales.
Cathepsin L substrate Substrat (CAS 65147-22-0) Références
- L'activité de la cathepsine S est détectable dans les kératinocytes humains et est sélectivement régulée à la hausse lors de la stimulation par l'interféron-gamma. | Schwarz, G., et al. 2002. J Invest Dermatol. 119: 44-9. PMID: 12164923
- Caractérisation de HC58cDNA, une cystéine protéase putative du parasite Haemonchus contortus. | Muleke, CI., et al. 2006. J Vet Sci. 7: 249-55. PMID: 16871019
- Activités des protéases à cystéine de type cathepsine B et L pendant le développement in vitro d'Hysterothylacium aduncum (Nematoda: Anisakidae), un parasite mondial du poisson. | Malagón, D., et al. 2010. Parasitol Int. 59: 89-92. PMID: 19932193
- L'activité endoprotéase à cystéine de la protéine ribosomale humaine S4 est entièrement due au domaine C-terminal et est compatible avec le mécanisme de Michaelis-Menten. | Sudhamalla, B., et al. 2013. Biochim Biophys Acta. 1830: 5342-9. PMID: 23791938
- L'apolipoprotéine B-100 des lipoprotéines plasmatiques de faible densité subit une protéolyse par des facteurs d'activation de contact lorsque le plasma est traité avec du sulfate de dextran-500-MgCl2. | Byrne, RE. and Scanu, AM. 1989. J Lipid Res. 30: 109-20. PMID: 2465366
- Identification de la cathepsine B de la grande croûte jaune (Pseudosciaena crocea) et son rôle dans le traitement de la chaîne invariante associée au CMH de classe II. | Li, M., et al. 2014. Dev Comp Immunol. 45: 313-20. PMID: 24705226
- Augmentation de l'expression et de l'activité enzymatique de la cystéine protéinase B au cours de la différenciation in vitro de Leishmania (Viannia) braziliensis: Première preuve de modulation au cours de la transition morphologique. | Gomes, CB., et al. 2017. Biochimie. 133: 28-36. PMID: 27919786
- Identification et caractéristiques d'une protéase à cystéine de type cathepsine L de Clonorchis sinensis. | Ma, C., et al. 2019. Parasitol Res. 118: 829-835. PMID: 30689051
- Le clivage différentiel de substrats spécifiques pour une activité semblable à celle de la cathepsine montre des activités de cystéine et de sérine protéase et un profil différentiel entre Anisakis simplex s.s. et Anisakis pegreffii, des espèces sœurs qui sont des agents étiologiques majeurs de l'anisakiase. | Torralbo-Ramírez, V., et al. 2019. Foodborne Pathog Dis. 16: 744-751. PMID: 31215796
- Profils des protéases à sérine d'isolats cliniques de Leishmania (Viannia) braziliensis présentant des sensibilités distinctes à l'antimoine. | Zabala-Peñafiel, A., et al. 2021. Sci Rep. 11: 14234. PMID: 34244581
- Le facteur de trafic des enzymes lysosomales LYSET permet l'utilisation nutritionnelle des protéines extracellulaires. | Pechincha, C., et al. 2022. Science. 378: eabn5637. PMID: 36074822
- Sécrétion de l'activité cystéine-protéinase par l'ankylostome zoonotique Ancylostoma caninum. | Dowd, AJ., et al. 1994. Am J Trop Med Hyg. 51: 341-7. PMID: 7943555
- Cathepsine B de Schistosoma mansoni. Purification et activation de la proenzyme recombinante sécrétée par Saccharomyces cerevisiae. | Lipps, G., et al. 1996. J Biol Chem. 271: 1717-25. PMID: 8576174
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Cathepsin L substrate, 5 mg | sc-3136A | 5 mg | $102.00 | |||
Cathepsin L substrate, 25 mg | sc-3136 | 25 mg | $265.00 | |||
Cathepsin L substrate, 100 mg | sc-3136B | 100 mg | $708.00 |
