
Biotin-XX phalloidin
Voir les citations produits (2)
ACCÈS RAPIDE AUX LIENS
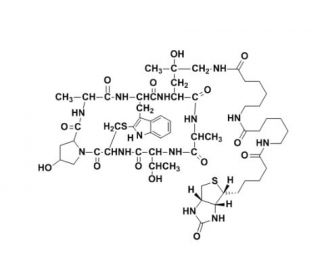
La phalloïdine Biotin-XX, une puissante sonde de F-actine couplée à la biotine-XX, est utile pour marquer sélectivement la F-actine dans les applications d'imagerie. Dérivée de la phalloïdine, un peptide bicyclique obtenu à partir du champignon vénéneux Amanita phalloides, cette sonde présente une grande affinité et une coloration non spécifique minimale. Sa compatibilité avec divers colorants fluorescents, tels que les protéines fluorescentes, les nanocristaux Qdot™ et les conjugués Alexa Fluor™, y compris les anticorps secondaires, permet une visualisation et une quantification complètes et très contrastées de la F-actine dans les cultures cellulaires, les coupes de tissus et les préparations acellulaires.
Biotin-XX phalloidin Références
- Le substrat de la phosphatase ELF -97 constitue une méthode sensible et photostable de marquage des cibles cytologiques. | Paragas, VB., et al. 2002. J Microsc. 206: 106-19. PMID: 12000550
- Processus de la myosine V: voies cinétiques multiples pour la coordination tête à tête. | Baker, JE., et al. 2004. Proc Natl Acad Sci U S A. 101: 5542-6. PMID: 15056760
- Détection de petites différences dans la fonction de l'actomyosine en utilisant de l'actine marquée avec différents conjugués de phalloïdine. | Balaz, M. and Månsson, A. 2005. Anal Biochem. 338: 224-36. PMID: 15745742
- Extension des capacités multicolores des microscopes confocaux de base par l'utilisation de conjugués de points quantiques dans le rouge et le proche infrarouge. | Kingeter, LM. and Schaefer, BC. 2009. BMC Biotechnol. 9: 49. PMID: 19463154
- La boucle D de l'actine régule différemment la fonction motrice des myosines II et V. | Kubota, H., et al. 2009. J Biol Chem. 284: 35251-8. PMID: 19840951
- L'essai de motilité par super-résolution de l'actine marquée au Qdot mesure la taille de l'étape de la myosine musculaire à faible cycle de travail. | Wang, Y., et al. 2013. Biochemistry. 52: 1611-21. PMID: 23383646
- La myosine ventriculaire modifie la taille du pas in vitro lorsqu'elle est phosphorylée. | Wang, Y., et al. 2014. J Mol Cell Cardiol. 72: 231-7. PMID: 24726887
- Taille des pas de myosine unique in vitro et in vivo dans le muscle strié. | Burghardt, TP., et al. 2015. J Muscle Res Cell Motil. 36: 463-77. PMID: 26728749
- Excitation à trois photons à grand champ dans des échantillons biologiques. | Rowlands, CJ., et al. 2017. Light Sci Appl. 6: e16255. PMID: 29152380
- Assemblage équatorial de l'anneau d'actomyosine de division cellulaire en l'absence de repères spatiaux cytokinétiques. | Lim, TC., et al. 2018. Curr Biol. 28: 955-962.e3. PMID: 29502950
- Le PDMS non durci inhibe la motilité de la myosine in vitro dans une cellule d'écoulement microfluidique. | Wang, Y. and Burghardt, TP. 2018. Anal Biochem. 563: 56-60. PMID: 30300623
- La signalisation NELL2-cdc42 régule les complexes BAF et la croissance des cellules du sarcome d'Ewing. | Jayabal, P., et al. 2021. Cell Rep. 36: 109254. PMID: 34233189
- L'activation de SIRT1 favorise le recollement de la membrane par l'intermédiaire de la cortactine. | Iwahara, N., et al. 2022. Sci Rep. 12: 15328. PMID: 36097021
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Biotin-XX phalloidin, 100 unit | sc-505886 | 100 unit | $354.00 |
