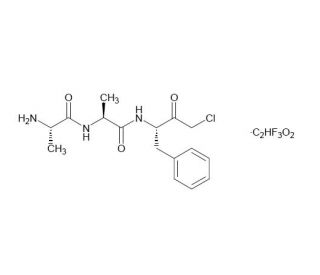
AAF-CMK (CAS 184901-82-4)
Voir les citations produits (1)
ACCÈS RAPIDE AUX LIENS
L'AAF-CMK est un peptide synthétique qui sert d'inhibiteur irréversible et est utilisé en recherche biochimique pour étudier l'activité des protéases, en particulier celle des protéases à sérine. Le composé comporte un groupe Acétyle et un groupement chlorométhylcétone réactif, qui interagit avec le site actif des protéases cibles, entraînant l'alkylation du résidu sérine et donc l'inactivation de l'enzyme. En inhibant des protéases spécifiques, l'AAF-CMK permet aux chercheurs de disséquer les rôles joués par ces enzymes dans divers processus biologiques, tels que l'apoptose, la signalisation cellulaire et la dégradation des protéines intracellulaires. Il est également utilisé dans l'étude de la régulation des protéases et de la spécificité des interactions enzyme-substrat. L'utilisation de l'AAF-CMK dans les essais biochimiques permet d'élucider les mécanismes qui sous-tendent la fonction des protéases et leurs implications dans la physiologie et la pathologie cellulaires. En outre, cet inhibiteur est utilisé dans le développement de nouvelles stratégies pour moduler l'activité des protéases, ce qui peut avoir des applications dans divers domaines, y compris la biotechnologie et l'étude des conditions dans lesquelles les protéases sont des facteurs clés.
AAF-CMK (CAS 184901-82-4) Références
- La tripeptidyl peptidase I, produit du gène de la céroïde lipofuscinose neuronale infantile tardive, initie la dégradation lysosomale de la sous-unité c de l'ATP synthase. | Ezaki, J., et al. 2000. J Biochem. 128: 509-16. PMID: 10965052
- La tripeptidyl peptidase II favorise la maturation de la caspase-1 dans l'apoptose des macrophages induite par Shigella flexneri. | Hilbi, H., et al. 2000. Infect Immun. 68: 5502-8. PMID: 10992446
- Effets d'un inhibiteur de la tripeptidyl peptidase II (Ala-Ala-Phe-chlorométhylcétone) et de sa combinaison avec un inhibiteur de l'activité chymotrypsine-like du protéasome (PSI) sur l'apoptose, le cycle cellulaire et l'activité du protéasome dans les cellules U937. | Bury, M., et al. 2001. Folia Histochem Cytobiol. 39: 131-2. PMID: 11374791
- Lien entre le traitement des antigènes spécifiques aux organes par les protéasomes 20S et l'auto-immunité médiée par les cellules T CD8(+). | Kuckelkorn, U., et al. 2002. J Exp Med. 195: 983-90. PMID: 11956289
- La caractérisation structurelle et enzymatique de la physarolisine (anciennement physaropepsine) prouve qu'il s'agit d'une sérine-carboxyl-protéinase unique. | Nishii, W., et al. 2003. Biochem Biophys Res Commun. 301: 1023-9. PMID: 12589815
- La chaperonine TRiC du groupe II protège les intermédiaires protéolytiques de la dégradation dans la voie de traitement des antigènes de classe I du CMH. | Kunisawa, J. and Shastri, N. 2003. Mol Cell. 12: 565-76. PMID: 14527404
- Existe-t-il une alternative au protéasome dans la dégradation des protéines cytosoliques ? | Antón, LC. and Villasevil, EM. 2008. Biochem Soc Trans. 36: 839-42. PMID: 18793147
- La phospholipase A2 bêta indépendante du calcium n'est pas nécessaire à l'activation de l'inflammasome et à son inhibition par le bromoenol lactone. | Franchi, L., et al. 2009. J Innate Immun. 1: 607-17. PMID: 20160900
- Caractérisation des cellules de mésothéliome I-45 adaptées au bortézomib. | Zhang, L., et al. 2010. Mol Cancer. 9: 110. PMID: 20482802
- L'accumulation de protéines polyubiquitylées en réponse à l'Ala-Ala-Phe-chlorométhylcétone est indépendante de l'inhibition de la Tripeptidyl peptidase II. | Villasevil, EM., et al. 2010. Biochim Biophys Acta. 1803: 1094-105. PMID: 20553980
- L'inhibiteur semi-spécifique de la TPPII Ala-Ala-Phe-chlorométhylcétone (AAF-cmk) présente une activité cytotoxique par induction de l'apoptose, de l'autophagie et de l'agrégation des protéines dans les cellules U937. | Bialy, LP., et al. 2018. Folia Histochem Cytobiol. 56: 185-194. PMID: 30294774
- Un criblage à haut contenu identifie TPP1 et Aurora B comme régulateurs du transport mitochondrial axonal. | Shlevkov, E., et al. 2019. Cell Rep. 28: 3224-3237.e5. PMID: 31533043
- Purification et caractérisation d'une tripeptidyl aminopeptidase I de la rate de rat. | Vines, D. and Warburton, MJ. 1998. Biochim Biophys Acta. 1384: 233-42. PMID: 9659384
- Une protéase géante susceptible de remplacer certaines fonctions du protéasome. | Geier, E., et al. 1999. Science. 283: 978-81. PMID: 9974389
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
AAF-CMK, 5 mg | sc-205591 | 5 mg | $94.00 | |||
AAF-CMK, 25 mg | sc-205591A | 25 mg | $317.00 |
