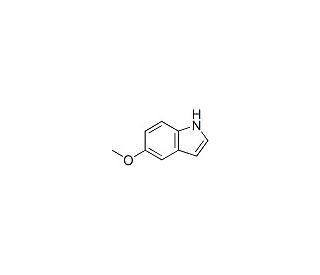
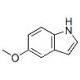
Structure moléculaire de 5-Methoxyindole, Numéro CAS: 1006-94-6
5-Methoxyindole (CAS 1006-94-6)
Noms alternatifs:
Femedol
Application(s):
5-Methoxyindole est un composé méthoxy indole simple
Numéro CAS:
1006-94-6
Masse Moléculaire:
147.17
Formule Moléculaire:
C9H9NO
Pour la Recherche Uniquement. Non conforme pour le Diagnostic ou pour une Utilisation Thérapeutique.
* Consulter le Certificat d'Analyses pour les données spécifiques à un lot (incluant la teneur en eau).
ACCÈS RAPIDE AUX LIENS
Informations pour la commande
Description
Information Technique
Données de Sécurité
SDS & Certificat d’Analyses
Le 5-méthoxyindole est un composé méthoxy-indole simple. Possédant la structure réduite des indoles pertinents de la famille des tryptamines, le 5-méthoxyindole est un composé utile pour la synthèse et la caractérisation des interactions entre les espèces indoliques. Le 5-méthoxyindole présente un agonisme partiel au niveau du récepteur 5-HT3A et une double activité agoniste/inverse au niveau du récepteur 5-HT3B.
5-Methoxyindole (CAS 1006-94-6) Références
- Une procédure simple pour la synthèse du roxindole, un agoniste des récepteurs D2 de la dopamine. | Csende, F. 2001. Arch Pharm (Weinheim). 334: 253-4. PMID: 11512277
- La sous-unité 5-HT3B confère une ouverture spontanée du canal et des propriétés de ligand modifiées du récepteur 5-HT3. | Hu, XQ. and Peoples, RW. 2008. J Biol Chem. 283: 6826-31. PMID: 18187416
- Spectroscopie électronique résolue par rotation du 5-méthoxyindole. | Brand, C., et al. 2010. J Chem Phys. 133: 024303. PMID: 20632751
- Mécanisme de synthèse directe du tryptophane à partir de l'indole et de la sérine: une technique RMN utile pour la détection d'un intermédiaire réactif dans le mélange réactionnel. | Yokoyama, Y., et al. 2010. Magn Reson Chem. 48: 811-7. PMID: 20799376
- Synthèses totales convergentes des alcaloïdes lycoranine A, lycoranine B et 2-méthoxypratosine des Amaryllidaceae. | Kim, HS., et al. 2013. J Org Chem. 78: 5103-9. PMID: 23607814
- Auto-inhibition au niveau d'un canal ionique ligand-gated: une diaphonie entre les sites orthostériques et allostériques. | Hu, XQ. 2015. Br J Pharmacol. 172: 93-105. PMID: 25176133
- Biotransformation de l'indole et de ses dérivés par un Enterobacter sp. M9Z nouvellement isolé. | Qu, Y., et al. 2015. Appl Biochem Biotechnol. 175: 3468-78. PMID: 25725798
- Détermination des moments dipolaires des états fondamental et excité par spectroscopie électronique Stark: 5-méthoxyindole. | Wilke, J., et al. 2016. J Chem Phys. 144: 044201. PMID: 26827210
- Changements conformationnels dans le 5-méthoxyindole: Effets des excitations thermiques, vibrationnelles et électroniques. | Lopes Jesus, AJ., et al. 2017. J Phys Chem A. 121: 3372-3382. PMID: 28409925
- Formation de radicaux induite par les UV et isomérisation du 4-méthoxyindole et du 5-méthoxyindole. | Lopes Jesus, AJ., et al. 2020. Phys Chem Chem Phys. 22: 22943-22955. PMID: 33026378
- La mélatonine et ses homologues induisent des réponses immunitaires via les récepteurs trP47363-trP13076 chez Nicotiana benthamiana. | Kong, M., et al. 2021. Front Plant Sci. 12: 691835. PMID: 34276740
- Alcaloïde de crapaud pour la découverte de pesticides: Dehydrobufotenine Derivatives as Novel Agents against Plant Virus and Fungi (Dérivés de la déhydrobufoténine comme nouveaux agents contre les virus et les champignons des plantes). | Tian, Z., et al. 2021. J Agric Food Chem. 69: 9754-9763. PMID: 34415761
- Le 5-méthoxyindole, un homologue chimique de la mélatonine, affecte négativement le champignon phytopathogène Fusarium graminearum. | Kong, M., et al. 2021. Int J Mol Sci. 22: PMID: 34681652
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
5-Methoxyindole, 1 g | sc-202023 | 1 g | $36.00 | |||
5-Methoxyindole, 5 g | sc-202023A | 5 g | $118.00 |
