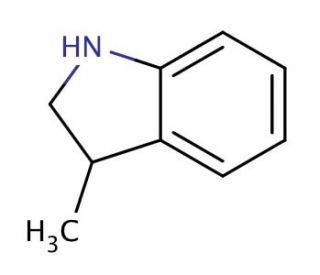
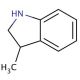
Structure moléculaire de 3-methylindoline, Numéro CAS: 4375-15-9
3-methylindoline (CAS 4375-15-9)
Numéro CAS:
4375-15-9
Masse Moléculaire:
133.19
Formule Moléculaire:
C9H11N
Pour la Recherche Uniquement. Non conforme pour le Diagnostic ou pour une Utilisation Thérapeutique.
* Consulter le Certificat d'Analyses pour les données spécifiques à un lot (incluant la teneur en eau).
ACCÈS RAPIDE AUX LIENS
Informations pour la commande
Description
Information Technique
Données de Sécurité
SDS & Certificat d’Analyses
La 3-méthylindoline est un composé organique hétérocyclique connu pour ses anneaux contenant de l'azote. Ce composé a un large éventail d'applications et est très polyvalent. Il possède plusieurs propriétés avantageuses qui en font un choix privilégié pour les expériences de laboratoire. Il est également utilisé comme composé modèle dans l'étude des systèmes biologiques, y compris les enzymes et les protéines. En outre, la 3-méthylindoline a été utilisée pour examiner le mécanisme d'action des médicaments.
3-methylindoline (CAS 4375-15-9) Références
- Synthèse hautement énantiosélective d'indolines chirales substituées en position 3 par hydrogénation catalytique asymétrique d'indoles. | Kuwano, R., et al. 2004. Org Lett. 6: 2213-5. PMID: 15200323
- Synthèse de N-hétérocycles benzannulés par couplage C-C/C-N de bromoalkylamines catalysé par le palladium. | Thansandote, P., et al. 2007. Org Lett. 9: 5255-8. PMID: 18001046
- Approche générale de la synthèse totale d'alcaloïdes indoliques substitués par 9-méthoxy: synthèse de la mitragynine, ainsi que du 9-méthoxygeissoschizol et du 9-méthoxy-N(b)-méthylgeissoschizol. | Ma, J., et al. 2009. J Org Chem. 74: 264-73. PMID: 19046119
- Isomérisation redox via des intermédiaires azométhine-ylide: N-alkyl indoles à partir d'indolines et d'aldéhydes. | Deb, I., et al. 2011. Org Lett. 13: 812-5. PMID: 21247142
- Carbonickelation intramoléculaire d'alcènes. | Lhermet, R., et al. 2013. Beilstein J Org Chem. 9: 710-6. PMID: 23766783
- Synthèse asymétrique d'anilides axialement chiraux catalysée par transfert de phase. | Liu, K., et al. 2013. Chem Asian J. 8: 3214-21. PMID: 24273122
- Transfert formel d'aromaticité pour le couplage catalysé par le palladium entre les phénols et les pyrrolidines/indolines. | Qiu, Z., et al. 2017. Chem Sci. 8: 6954-6958. PMID: 29147521
- Synthèse sélective d'indolines et d'indoles N-alcylés, catalysée par le fer. | Wu, J., et al. 2022. Chemistry. 28: e202201809. PMID: 35700072
- Pyrolyse d'oxindoles à 850°C. II. Oxindoles méthylés en N1 et en C3 | RFC Brown, M Butcher. 1973. Australian Journal of Chemistry. 26(2.) 369 - 374.
- Alcaloïdes bromo-substitués de la physostigmine provenant d'un bryozoaire marin, Flustra foliacea | . 1979,. J. Am. Chem. Soc. 101, 14,: 4012–4013.
- Routes vers les indolines 2-substituées énantiopures: une vue d'ensemble | S Anas, HB Kagan -. October 2009. Tetrahedron: Asymmetry. Volume 20, Issue 19, 6:, Pages 2193-2199.
- Avancées récentes dans la méthode et le mécanisme de synthèse de l'important composé N-hétérocyclique du 3-méthylindole | . 24 January 2022. Journal of Heterocyclic Chemistry. Volume59, Issue7: Pages 1135-1143.
- Préparation d'indolines différentiellement 1,3-disubstituées par carbolithiation intramoléculaire | WF Bailey, MR Luderer, MJ Mealy. 7 July 2003, Pages 5303-5305. Tetrahedron Letters. Volume 44, Issue 28,: 7 July 2003, Pages 5303-5305.
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
3-methylindoline, 1 g | sc-347182 | 1 g | $435.00 | |||
3-methylindoline, 5 g | sc-347182A | 5 g | $1203.00 |
