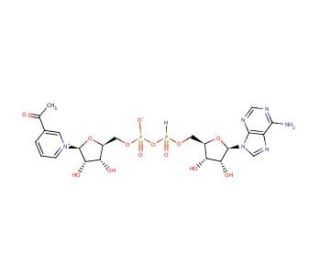
Structure moléculaire de 3-Acetylpyridine adenine dinucleotide, Numéro CAS: 86-08-8
3-Acetylpyridine adenine dinucleotide (CAS 86-08-8)
Voir les citations produits (3)
Noms alternatifs:
APAD, Oxidized
Application(s):
3-Acetylpyridine adenine dinucleotide est un analogue du NAD
Numéro CAS:
86-08-8
Pureté:
≥92%
Masse Moléculaire:
662.44
Formule Moléculaire:
C22H28N6O14P2
Pour la Recherche Uniquement. Non conforme pour le Diagnostic ou pour une Utilisation Thérapeutique.
* Consulter le Certificat d'Analyses pour les données spécifiques à un lot (incluant la teneur en eau).
ACCÈS RAPIDE AUX LIENS
Informations pour la commande
Références bibliographiques
Description
Information Technique
Données de Sécurité
SDS & Certificat d’Analyses
Le 3-acétylpyridine adénine dinucléotide est un analogue du NAD avec un potentiel d'oxydation plus élevé que le NAD. Il peut remplacer le NAD en tant que cofacteur acceptant l'hydrogène dans de nombreuses réactions de déshydrogénase, par exemple la lactate déshydrogénase de Toxoplasma, Clonorchis et Plasmodium, la lipoamide déshydrogénase bactérienne, ainsi que les déshydrogénases des mammifères. Ce composé peut également agir comme accepteur de protons dans diverses réactions de transhydrogénation avec le NADH ou le NADPH.
3-Acetylpyridine adenine dinucleotide (CAS 86-08-8) Références
- Propriétés cinétiques et sensibilité aux inhibiteurs des lactate déshydrogénases (LDH1 et LDH2) de Toxoplasma gondii: comparaisons avec la pLDH de Plasmodium falciparum. | Dando, C., et al. 2001. Mol Biochem Parasitol. 118: 23-32. PMID: 11704270
- Cinétique de la réaction de transhydrogénase catalysée par la NADH:ubiquinone oxydoréductase mitochondriale (complexe I). | Zakharova, NV. 2002. Biochemistry (Mosc). 67: 651-61. PMID: 12126472
- Structure de la LDH1 de Toxoplasma gondii: différences entre le site actif et les lactate déshydrogénases humaines et base structurale pour une utilisation efficace de l'APAD+. | Kavanagh, KL., et al. 2004. Biochemistry. 43: 879-89. PMID: 14744130
- Clonage moléculaire et caractérisation d'un nouveau gène de lactate déshydrogénase de Clonorchis sinensis. | Yang, G., et al. 2006. Parasitol Res. 99: 55-64. PMID: 16479375
- Porteurs d'électrons artificiels pour la synthèse photoenzymatique sous lumière visible. | Lee, SH., et al. 2012. Chemistry. 18: 5490-5. PMID: 22488767
- Méthode de cycle enzymatique pour le 3-acétylpyridine adénine dinucléotide afin d'augmenter la sensibilité des méthodes enzymatiques qui utilisent cet analogue du NAD. | Ferrier, B. 1990. Anal Biochem. 186: 229-32. PMID: 2363493
- Thioredoxin Reductase-Type Ferredoxin: NADP+ Oxidoreductase of Rhodopseudomonas palustris: Caractéristiques potentiométriques et réactions avec des oxydants non physiologiques. | Lesanavičius, M., et al. 2022. Antioxidants (Basel). 11: PMID: 35624864
- L'analyse du mécanisme cinétique de la NADH peroxydase entérocoque révèle le rôle catalytique des complexes NADH avec les formes oxydées et réduites à deux électrons de l'enzyme. | Crane, EJ., et al. 1995. Biochemistry. 34: 14114-24. PMID: 7578008
- Mécanisme de transfert d'hydrure entre NADH et 3-acétylpyridine adénine dinucléotide par la pyridine nucléotide transhydrogénase d'Escherichia coli. | Glavas, NA. and Bragg, PD. 1995. Biochim Biophys Acta. 1231: 297-303. PMID: 7578217
- Activité élevée de la transhydrogénase cyclique catalysée par les domaines de liaison aux nucléotides exprimés et reconstitués de la transhydrogénase de Rhodospirillum rubrum. | Yamaguchi, M. and Hatefi, Y. 1997. Biochim Biophys Acta. 1318: 225-34. PMID: 9030266
- Tests d'ingénierie protéique d'un modèle d'homologie de la lactate déshydrogénase de Plasmodium falciparum. | Hewitt, CO., et al. 1997. Protein Eng. 10: 39-44. PMID: 9051732
- Propriétés catalytiques de la lipoamide déshydrogénase de Mycobacterium smegmatis. | Marcinkeviciene, J. and Blanchard, JS. 1997. Arch Biochem Biophys. 340: 168-76. PMID: 9143318
- La réduction de l'acétylpyridine adénine dinucléotide par le NADH: s'agit-il d'une réaction importante de la transhydrogénase translocatrice de protons ou d'un artefact ? | Stilwell, SN., et al. 1997. Biochim Biophys Acta. 1320: 83-94. PMID: 9186780
- Des mutations à la tyrosine 235 dans la région de la boucle mobile de la protéine du domaine I de la transhydrogénase de Rhodospirillum rubrum inhibent fortement le transfert d'hydrure. | Bizouarn, T., et al. 1997. Biochim Biophys Acta. 1320: 265-74. PMID: 9230921
- Spécificité du substrat et du cofacteur et inhibition sélective de la lactate déshydrogénase du parasite du paludisme P. falciparum. | Gomez, MS., et al. 1997. Mol Biochem Parasitol. 90: 235-46. PMID: 9497046
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
3-Acetylpyridine adenine dinucleotide, 25 mg | sc-209519 | 25 mg | $105.00 | |||
3-Acetylpyridine adenine dinucleotide, 100 mg | sc-209519A | 100 mg | $304.00 |
