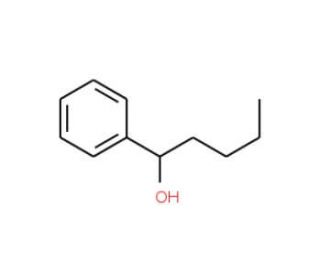
1-Phenyl-1-pentanol (CAS 583-03-9)
ACCÈS RAPIDE AUX LIENS
Le phényl-1-pentanol est un intermédiaire chimique dans la synthèse organique. Il agit comme un nucléophile dans diverses réactions, participant à des processus tels que les réactions de Grignard et la substitution nucléophile. Le phényl-1-pentanol peut également servir d'auxiliaire chiral, facilitant la synthèse asymétrique de molécules organiques. Au niveau moléculaire, le phényl-1-pentanol interagit avec d'autres réactifs pour former de nouvelles liaisons carbone-carbone ou carbone-hétéroatome, contribuant ainsi à la construction de structures moléculaires complexes. Son mécanisme d'action implique la formation d'intermédiaires qui subissent d'autres transformations pour donner les produits souhaités.
1-Phenyl-1-pentanol (CAS 583-03-9) Références
- Additions 1,2- stéréosélectives d'alpha-alkoxyméthyllithiums sur des aldéhydes. | Smyj, RP. and Chong, JM. 2001. Org Lett. 3: 2903-6. PMID: 11529786
- Introduction régiosélective d'électrophiles en position 4 du 1-Hydroxypyrazole via l'échange brome-lithium. | Balle, T., et al. 1999. J Org Chem. 64: 5366-5370. PMID: 11674594
- Un catalyseur phosphabicyclooctane hautement énantiosélectif pour la résolution cinétique des alcools benzyliques. | Vedejs, E. and Daugulis, O. 2003. J Am Chem Soc. 125: 4166-73. PMID: 12670239
- Comparaison de Chirasil-DEX CB comme phase stationnaire chirale pour la chromatographie en phase gazeuse et de ULMO comme phase stationnaire chirale pour la chromatographie en phase liquide pour l'énantioséparation d'aryl- et d'hétéroarylcarbinols. | Uray, G., et al. 2003. J Chromatogr A. 992: 151-7. PMID: 12735471
- Résolution cinétique oxydative d'alcools racémiques catalysée par des complexes chiraux de ferrocényloxazolinylphosphine-ruthénium. | Nishibayashi, Y., et al. 2003. J Org Chem. 68: 5875-80. PMID: 12868920
- Réactions concurrentes d'alcools secondaires avec l'hypochlorite de sodium favorisées par la catalyse de transfert de phase. | Bright, ZR., et al. 2005. J Org Chem. 70: 684-7. PMID: 15651819
- Alkylation d'aldéhydes catalysée par le nickel avec des trialkylboranes. | Hirano, K., et al. 2005. Org Lett. 7: 4689-91. PMID: 16209511
- Résolution cinétique d'alcools secondaires racémiques catalysée par des complexes diaminodiphosphine-Ir(I) chiraux. | Li, YY., et al. 2006. Org Lett. 8: 5565-7. PMID: 17107073
- Progrès dans la résolution cinétique oxydative asymétrique d'alcools secondaires racémiques catalysée par des complexes de salen Mn(III) chiraux. | Ahmad, I., et al. 2017. Chirality. 29: 798-810. PMID: 28963733
- [Étude expérimentale de l'activité cholérétique du 2'hydroxy-5'carboxy-1-phényl-1-pentanol]. | Van den Driessche, J., et al. 1968. Therapie. 23: 329-40. PMID: 5701508
- Études sur les interactions des alcools secondaires chiraux avec l'hydroxystéroïde sulfotransférase STa du rat. | Banoglu, E. and Duffel, MW. 1997. Drug Metab Dispos. 25: 1304-10. PMID: 9351908
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
1-Phenyl-1-pentanol, 10 g | sc-273438 | 10 g | $54.00 |
