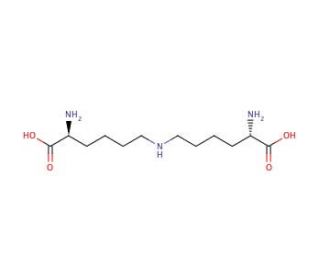
Lysinonorleucine (CAS 25612-46-8)
Ver las publicaciones del producto (2)
ENLACES RÁPIDOS
Lysinonorleucine es un dipeptido con aplicación en la investigación bioquímica debido a su papel como biomarcador para el daño de proteínas, especialmente en el estudio de la enlazación y degradación de proteínas. Se usa para evaluar la extensión de los eventos de oxidación y enlazación de proteínas bajo diversas condiciones experimentales, incluyendo estrés oxidativo y estudios de envejecimiento en sistemas celulares y de tejidos. La presencia de lysinonorleucina en proteínas es indicativa de productos finales de glicación avanzada (AGEs), que los investigadores analizan para entender el proceso de envejecimiento y los efectos a largo plazo de la hiperglucemia en los sistemas biológicos. Además, la lysinonorleucina está involucrada en la elucidación de vías relacionadas con el recambio de proteínas y las modificaciones post-traduccionales, proporcionando información sobre los mecanismos celulares para mantener la integridad de las proteínas. Su cuantificación también es esencial en el campo de la proteómica, donde ayuda en la caracterización de mezclas de proteínas complejas e identificación de nuevas interacciones proteína-proteína.
Lysinonorleucine (CAS 25612-46-8) Referencias
- Efecto de la hipergravedad y la microgravedad en los controles postraduccionales del colágeno de los osteoblastos MC3T3-E1. | Saito, M., et al. 2003. J Bone Miner Res. 18: 1695-705. PMID: 12968680
- Diferencias relacionadas con la intensidad en la modificación postraduccional del colágeno en osteoblastos MC3T3-E1 tras la exposición a ultrasonidos pulsados de baja y alta intensidad. | Saito, M., et al. 2004. Bone. 35: 644-55. PMID: 15336600
- Un sistema modelo de dos componentes para estudiar la arquitectura del ensamblaje de la elastina in vitro. | Mithieux, SM., et al. 2005. J Struct Biol. 149: 282-9. PMID: 15721582
- Reducción del grado de mineralización y de los enlaces cruzados enzimáticos del colágeno y aumento de la pentosidina inducida por glicación en la corteza del cuello femoral en casos de fractura del cuello femoral. | Saito, M., et al. 2006. Osteoporos Int. 17: 986-95. PMID: 16552468
- Papel de los enlaces cruzados enzimáticos del colágeno e inducidos por la glicación como determinantes de la calidad ósea en ratas WBN/Kob espontáneamente diabéticas. | Saito, M., et al. 2006. Osteoporos Int. 17: 1514-23. PMID: 16770520
- Elastina y proteína asociada a la elastina de la aorta y el pulmón porcinos. | Richmond, VL. 1990. Connect Tissue Res. 25: 131-7. PMID: 2175693
- Síntesis de enlaces cruzados de colágeno en cultivos de endotelio vascular. | Levene, CI., et al. 1989. Br J Exp Pathol. 70: 621-6. PMID: 2605112
- Evaluación de la reticulación derivada de la lisil oxidasa en el queratocono mediante cromatografía líquida/espectrometría de masas. | Takaoka, A., et al. 2016. Invest Ophthalmol Vis Sci. 57: 126-36. PMID: 26780316
- Reticulación heterogénea de la elastina. | Schräder, CU., et al. 2018. J Biol Chem. 293: 15107-15119. PMID: 30108173
- Las modificaciones de la alilsina perturban la estructura y movilidad de la tropoelastina a escala local y global. | Ozsvar, J., et al. 2019. Matrix Biol Plus. 2: 100002. PMID: 33543005
- Nucleósidos y aminoácidos, aislados de Cordyceps sinensis, protegieron contra la mielosupresión inducida por ciclofosfamida en ratones. | Zhang, Y., et al. 2022. Nat Prod Res. 36: 6056-6059. PMID: 35188001
- Digestión con elastasa y análisis bioquímico de la elastina de un elastofibroma. | Nakamura, Y., et al. 1986. Cancer. 58: 1070-5. PMID: 3637115
- Síntesis de lisinonorleucina y análisis por espectrometría de masas de lisinonorleucina y merodesmosina en ligamento bovino y membrana de cáscara de huevo. | Oishi, K., et al. 2023. Arch Biochem Biophys. 740: 109585. PMID: 37001748
- La histona H1 es un sustrato de la lisil oxidasa y contiene residuos endógenos reducibles por borotritida sódica. | Kagan, HM., et al. 1983. Biochem Biophys Res Commun. 115: 186-92. PMID: 6137217
- Detección de enlaces cruzados inmaduros, maduros y senescentes de colágeno mediante cromatografía líquida de alto rendimiento y fluorescencia en una sola columna. | Saito, M., et al. 1997. Anal Biochem. 253: 26-32. PMID: 9356137
Información sobre pedidos
| Nombre del producto | Número de catálogo | UNIDAD | Precio | CANTIDAD | Favoritos | |
Lysinonorleucine, 5 mg | sc-207837 | 5 mg | $337.00 |
