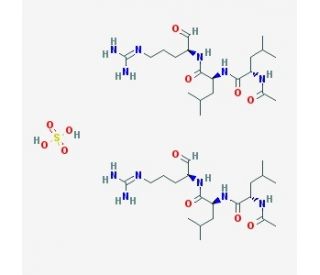
Leupeptin hemisulfate (CAS 103476-89-7)
Ver las publicaciones del producto (19)
ENLACES RÁPIDOS
Leupeptina hemisulfato es un inhibidor reversible y competitivo de proteasas que ha demostrado inhibir las catepsinas B, H, L y S, la calpaína y la tripsina. También es un inhibidor reversible de las proteasas de cisteína, serina y treonina que son producidas naturalmente por Streptomyces. Leupeptina hemisulfato no tiene efecto contra la quimotripsina, la elastasa, la renina o la pepsina. En la investigación bioquímica, se utiliza con frecuencia como agente reductor en experimentos diseñados para estudiar proteínas, enzimas, aminoácidos y neuropéptidos. Leupeptina hemisulfato también puede utilizarse como una herramienta de purificación de proteínas para evitar que las proteasas presentes en las muestras de tejido degraden la proteína de interés. En general, los investigadores lo utilizan para estudiar los efectos de la inhibición de proteasas en el metabolismo celular, la actividad enzimática, la expresión génica, la síntesis de proteínas, la degradación de proteínas y el plegamiento de proteínas.
Leupeptin hemisulfate (CAS 103476-89-7) Referencias
- Caracterización de los complejos intracelulares de transcripción inversa del virus de la inmunodeficiencia humana de tipo 1. | Fassati, A. and Goff, SP. 2001. J Virol. 75: 3626-35. PMID: 11264352
- Análisis de secuencias, distribución tisular y expresión de la catepsina S de rata. | Petanceska, S. and Devi, L. 1992. J Biol Chem. 267: 26038-43. PMID: 1281481
- La fosforilación de la quinasa p70s6 está implicada en el anabolismo del músculo elevador del ano inducido por andrógenos en ratas castradas. | Xu, T., et al. 2004. J Steroid Biochem Mol Biol. 92: 447-54. PMID: 15698549
- Microtúbulos en células mesófilas de espinacas no aclimatadas y aclimatadas al frío: visualización y respuestas a la congelación, baja temperatura y deshidratación. | Bartolo, ME. and Carter, JV. 1991. Plant Physiol. 97: 175-81. PMID: 16668366
- Inhibidores de la catepsina B. | Frlan, R. and Gobec, S. 2006. Curr Med Chem. 13: 2309-27. PMID: 16918357
- Caracterización de promotores vasculoespecíficos RSs1 y rolC para su utilización en plantas de ingeniería para desarrollar resistencia contra plagas de insectos hemípteros. | Saha, P., et al. 2007. Planta. 226: 429-42. PMID: 17323077
- Análisis de las limitaciones de la expresión del antígeno de superficie de la hepatitis B en cultivos de suspensión de células de soja. | Ganapathi, TR., et al. 2007. Plant Cell Rep. 26: 1575-84. PMID: 17534624
- Aislamiento de Anillos de Actomiosina Citocinética de Saccharomyces cerevisiae y Schizosaccharomyces pombe. | Huang, J., et al. 2016. Methods Mol Biol. 1369: 125-136. PMID: 26519310
- Inhibición de las actividades proteolíticas de células vegetales que degradan la tubulina. | Morejohn, LC., et al. 1985. Cell Biol Int Rep. 9: 849-57. PMID: 2864138
- Preparación de vesículas recubiertas de clatrina a partir de plántulas de Arabidopsis thaliana. | Mosesso, N., et al. 2018. Front Plant Sci. 9: 1972. PMID: 30687367
- Leupeptinas, nuevos inhibidores de proteasas de Actinomycetes. | Aoyagi, T., et al. 1969. J Antibiot (Tokyo). 22: 283-6. PMID: 5810993
- Polimerización de microtúbulos rosados inducida por taxol in vitro y su inhibición por colchicina. | Morejohn, LC. and Fosket, DE. 1984. J Cell Biol. 99: 141-7. PMID: 6145718
- Catepsina B, Catepsina H y Catepsina L. | Barrett, AJ. and Kirschke, H. 1981. Methods Enzymol. 80 Pt C: 535-61. PMID: 7043200
- Catepsina B humana. Aplicación del sustrato N-benciloxicarbonil-L-arginil-L-arginina 2-naftilamida a un estudio de la inhibición por la leupeptina. | Knight, CG. 1980. Biochem J. 189: 447-53. PMID: 7213339
Información sobre pedidos
| Nombre del producto | Número de catálogo | UNIDAD | Precio | CANTIDAD | Favoritos | |
Leupeptin hemisulfate, 5 mg | sc-295358 | 5 mg | $73.00 | |||
Leupeptin hemisulfate, 10 mg | sc-295358C | 10 mg | $101.00 | |||
Leupeptin hemisulfate, 25 mg | sc-295358A | 25 mg | $148.00 | |||
Leupeptin hemisulfate, 50 mg | sc-295358D | 50 mg | $316.00 | |||
Leupeptin hemisulfate, 100 mg | sc-295358E | 100 mg | $499.00 | |||
Leupeptin hemisulfate, 500 mg | sc-295358B | 500 mg | $1427.00 |
