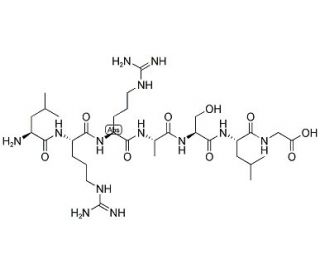
Estructura molecular de Kemptide, Número CAS: 65189-71-1
Kemptide (CAS 65189-71-1)
Solicitud:
Kemptide es un péptido aceptor de fosfato
Número de CAS:
65189-71-1
Pureza:
≥97%
Peso Molecular:
771.92
Fórmula Molecular:
C32H61N13O9
Para Uso Exclusivo en Investigación. No está diseñado para uso en diagnosis o terapia.
* En el Certificado de Análisis específico de lote, puede encontrar información específica (como el contenido en agua).
ENLACES RÁPIDOS
Información sobre pedidos
Descripción
Información Técnica
Información de Seguridad
SDS & Certificado de Análisis
Se demuestra que el kemptide, aceptor de fosfato, es un heptapéptido básico que contiene serina y corresponde a una secuencia de la piruvato quinasa de hígado de cerdo. Este péptido sintético es un sustrato de la proteína cinasa dependiente de AMP cíclico y se fosforila y activa tras su microinyección en ovocitos de Xenopus. La exposición del Kemptide a la insulina ha demostrado un aumento de la activación de este agente, que puede ser inhibido por la subunidad catalítica de la fosfatasa 2A.
Kemptide (CAS 65189-71-1) Referencias
- Ensayo enzimático de proteína quinasa mediante cromatografía electrocinética micelar con detección de fluorescencia inducida por láser. | Sano, M., et al. 2003. J Chromatogr B Analyt Technol Biomed Life Sci. 794: 149-56. PMID: 12888207
- Una cemptida quinasa purificada de hígado de rata estimulada por insulina es desactivada por la fosfatasa 2A. | Klarlund, JK., et al. 1991. J Biol Chem. 266: 4052-5. PMID: 1847913
- Biosensor mejorado con plata asistida por TiO2 para el perfil de actividad de quinasas. | Ji, J., et al. 2009. Chem Commun (Camb). 1508-10. PMID: 19277372
- [Estudio sobre el mecanismo del formiato sódico que potencia la quimioluminiscencia del luminol y su aplicación en medio micelar]. | Pomerantz, AH., et al. 1977. Proc Natl Acad Sci U S A. 74: 4261-5. PMID: 200911
- Fosforilación in vivo de un péptido sintético sustrato de la proteína cinasa dependiente de AMP cíclico. | Maller, JL., et al. 1978. Proc Natl Acad Sci U S A. 75: 248-51. PMID: 203933
- Determinación de la actividad de la proteína cinasa dependiente de AMPc soluble en el músculo liso traqueal de cobaya. Utilización preferente de la kemptida como sustrato fosforilante. | Langlands, JM. and Rodger, IW. 1990. Biochem Pharmacol. 39: 1365-74. PMID: 2322318
- Estudios de simulación de dinámica molecular sobre la cooperatividad positiva del sustrato Kemptide con la proteína cinasa A inducida por el ligando ATP. | Li, C., et al. 2014. J Phys Chem B. 118: 1273-87. PMID: 24456306
- Estudio de la afinidad entre la proteína cinasa PKA y sustratos peptídicos derivados de la cemptida mediante simulaciones de dinámica molecular y MM/GBSA. | Mena-Ulecia, K., et al. 2014. PLoS One. 9: e109639. PMID: 25275314
- Evidencia de actividad ecto-proteína quinasa que fosforila Kemptide en un modo dependiente de AMP cíclico. | Kübler, D., et al. 1989. J Biol Chem. 264: 14549-55. PMID: 2547801
- Un estudio QM/MM de la fosforilación de Kemptide catalizada por la proteína quinasa A. El papel de Asp166 como catalizador general ácido/base. | Pérez-Gallegos, A., et al. 2015. Phys Chem Chem Phys. 17: 3497-511. PMID: 25535906
- La fosforilación de sustratos puede inhibir la proteólisis por enzimas similares a la tripsina. | Benore-Parsons, M., et al. 1989. Arch Biochem Biophys. 272: 274-80. PMID: 2751304
- Biosensor fotoelectroquímico de alta sensibilidad para la detección e inhibición de la actividad quinasa basado en el reconocimiento de defectos superficiales y la amplificación múltiple de señales de los marcos metal-orgánicos. | Wang, Z., et al. 2017. Biosens Bioelectron. 97: 107-114. PMID: 28582705
- Estudio de la afinidad entre la proteína cinasa PKA y péptidos que contienen homoarginina derivados de la cemptida: Cálculos de perturbación de la energía libre (FEP). | Mena-Ulecia, K., et al. 2018. J Comput Chem. 39: 986-992. PMID: 29399821
- Los oxoaniones de vanadio y la proteína cinasa dependiente de AMPc: un inhibidor antisustrato. | Pluskey, S., et al. 1997. Biochem J. 321 (Pt 2): 333-9. PMID: 9020863
- NOTA TÉCNICA: medición de la actividad de la proteína cinasa dependiente de AMPc utilizando un kemptide marcado con fluorescencia. | MacAla, LJ., et al. 1998. Kidney Int. 54: 1746-50. PMID: 9844154
Sustrato de:
Enzyme, y PKA.Información sobre pedidos
| Nombre del producto | Número de catálogo | UNIDAD | Precio | CANTIDAD | Favoritos | |
Kemptide, 1 mg | sc-201153 | 1 mg | $46.00 |
