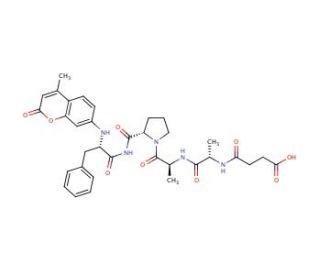
Chymotrypsin Substrate II, Fluorogenic (CAS 88467-45-2)
ENLACES RÁPIDOS
El sustrato de quimotripsina II, fluorogénico es un péptido especialmente diseñado que sirve como sustrato para la enzima quimotripsina, una proteasa digestiva que escinde los enlaces peptídicos en el lado carboxilo de los aminoácidos aromáticos como la tirosina, el triptófano y la fenilalanina. El aspecto fluorogénico de este sustrato significa que, al ser escindido enzimáticamente por la quimotripsina, libera una señal fluorescente, lo que permite controlar en tiempo real la actividad de la enzima. Esta propiedad lo convierte en una herramienta inestimable en diversas aplicaciones analíticas y de investigación, en particular en el estudio de la actividad de las proteasas y la detección de inhibidores. Midiendo el aumento de la intensidad de la fluorescencia a medida que se escinde el sustrato, los investigadores pueden determinar la velocidad de la enzima, su afinidad por el sustrato (Km) y su eficacia catalítica (kcat), lo que permite comprender mejor su mecanismo catalítico.
Chymotrypsin Substrate II, Fluorogenic (CAS 88467-45-2) Referencias
- Pruebas de que la ciclofilina-A protege a las células contra el estrés oxidativo. | Doyle, V., et al. 1999. Biochem J. 341 (Pt 1): 127-32. PMID: 10377253
- La ciclofilina-A interviene en la activación de caspasas inducida por excitotoxinas en células neuronales B50 de rata. | Capano, M., et al. 2002. Biochem J. 363: 29-36. PMID: 11903043
- Desarrollo de ensayos de proteasas basados en plasma acoplado inductivamente-espectrometría de masas. | Lathia, US., et al. 2010. Anal Biochem. 398: 93-8. PMID: 19912984
- Expresión funcional de un nuevo inhibidor de la proteasa de tipo Kunitz del patógeno sanguíneo humano Schistosoma mansoni. | Ranasinghe, SL., et al. 2015. Parasit Vectors. 8: 408. PMID: 26238343
- Clonación y caracterización de dos potentes inhibidores de la proteasa tipo Kunitz de Echinococcus granulosus. | Ranasinghe, SL., et al. 2015. PLoS Negl Trop Dis. 9: e0004268. PMID: 26645974
- Actividad sinérgica entre dos proteínas antifúngicas, la defensina vegetal NaD1 y el inhibidor de la tripsina pancreática bovina. | Bleackley, MR., et al. 2017. mSphere. 2: PMID: 29062897
- Estructuras cristalinas del complejo de un inhibidor de la calicreína de Bauhinia bauhinioides con tripsina y modelado de complejos de calicreína. | Li, M., et al. 2019. Acta Crystallogr D Struct Biol. 75: 56-69. PMID: 30644845
- La captación de quimasa por los cardiomiocitos provoca la degradación de la miosina en la sobrecarga de volumen cardiaco. | Powell, PC., et al. 2019. Heliyon. 5: e01397. PMID: 30997426
- La inhibición de la catepsina G por Serpinb1 y Serpinb6 previene la necrosis programada en neutrófilos y monocitos y reduce la inflamación provocada por la GSDMD. | Burgener, SS., et al. 2019. Cell Rep. 27: 3646-3656.e5. PMID: 31216481
- Cribado e Identificación de Inhibidores de Metacaspasas: Evaluación del Mecanismo de Inhibición y de la Actividad Tripanocida. | Pérez, B., et al. 2021. Antimicrob Agents Chemother. 65: PMID: 33318019
- Inhibidores reversibles fotosensibles generan ultrasensibilidad en reacciones enzimáticas fuera de equilibrio. | Teders, M., et al. 2021. J Am Chem Soc. 143: 5709-5716. PMID: 33844531
- Escisión proteolítica de péptidos bioactivos y receptores activados por proteasas en la colitis aguda y postcolitis. | De Bruyn, M., et al. 2021. Int J Mol Sci. 22: PMID: 34639054
- El Efecto de los Inhibidores de la Serina Proteasa sobre el Dolor Visceral en Diferentes Modelos de Roedores con Insulto Intestinal. | Ceuleers, H., et al. 2022. Front Pharmacol. 13: 765744. PMID: 35721192
- Actividades enzimáticas extracelulares de cepas fúngicas pelágicas oceánicas y la influencia de la temperatura. | Salazar Alekseyeva, K., et al. 2022. J Fungi (Basel). 8: PMID: 35736054
- Descubrimiento y bases moleculares de los inhibidores de ciclofilina selectivos de subtipo. | Peterson, AA., et al. 2022. Nat Chem Biol. 18: 1184-1195. PMID: 36163383
Información sobre pedidos
| Nombre del producto | Número de catálogo | UNIDAD | Precio | CANTIDAD | Favoritos | |
Chymotrypsin Substrate II, Fluorogenic, 25 mg | sc-391097 | 25 mg | $193.00 |
