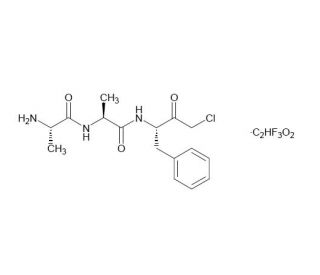
AAF-CMK (CAS 184901-82-4)
Ver las publicaciones del producto (1)
ENLACES RÁPIDOS
AAF-CMK es un péptido sintético que sirve como inhibidor irreversible y se utiliza en la investigación bioquímica para estudiar la actividad de proteasas, especialmente la de proteasas de serina. El compuesto presenta un grupo acetilo y una moiety de clorometil cetona reactiva, que interactúa con el sitio activo de las proteasas objetivo, lo que conduce a la alquilación del residuo de serina y, por lo tanto, inactiva la enzima. Al inhibir proteasas específicas, AAF-CMK permite a los investigadores desentrañar los roles que estas enzimas desempeñan en varios procesos biológicos, como la apoptosis, la señalización celular y la degradación de proteínas intracelulares. También se emplea en el estudio de la regulación de proteasas y la especificidad de las interacciones enzima-sustrato. El uso de AAF-CMK en ensayos bioquímicos ayuda a dilucidar los mecanismos subyacentes a la función de las proteasas y sus implicaciones en la fisiología celular y la patología. Además, este inhibidor se utiliza en el desarrollo de nuevas estrategias para modular la actividad de proteasas, lo que puede tener aplicaciones en varios campos, incluyendo la biotecnología y el estudio de condiciones donde las proteasas son factores clave.
AAF-CMK (CAS 184901-82-4) Referencias
- La tripeptidil peptidasa I, producto génico de la lipofuscinosis ceroide neuronal infantil tardía, inicia la degradación lisosomal de la subunidad c de la ATP sintasa. | Ezaki, J., et al. 2000. J Biochem. 128: 509-16. PMID: 10965052
- La tripeptidil peptidasa II promueve la maduración de la caspasa-1 en la apoptosis de macrófagos inducida por Shigella flexneri. | Hilbi, H., et al. 2000. Infect Immun. 68: 5502-8. PMID: 10992446
- Efectos de un inhibidor de la tripeptidil peptidasa II (Ala-Ala-Phe-clorometilcetona) y su combinación con un inhibidor de la actividad similar a la quimotripsina del proteasoma (PSI) sobre la apoptosis, el ciclo celular y la actividad del proteasoma en células U937. | Bury, M., et al. 2001. Folia Histochem Cytobiol. 39: 131-2. PMID: 11374791
- Relación entre el procesamiento de antígenos órgano-específicos por proteasomas 20S y la autoinmunidad mediada por células T CD8(+). | Kuckelkorn, U., et al. 2002. J Exp Med. 195: 983-90. PMID: 11956289
- La caracterización estructural y enzimática de la fsarolisina (antes fsaropepsina) demuestra que se trata de una serina-carboxilproteinasa única. | Nishii, W., et al. 2003. Biochem Biophys Res Commun. 301: 1023-9. PMID: 12589815
- La chaperonina del grupo II TRiC protege los intermediarios proteolíticos de la degradación en la vía de procesamiento de antígenos de clase I del CMH. | Kunisawa, J. and Shastri, N. 2003. Mol Cell. 12: 565-76. PMID: 14527404
- ¿Existe una alternativa al proteasoma en la degradación de proteínas citosólicas? | Antón, LC. and Villasevil, EM. 2008. Biochem Soc Trans. 36: 839-42. PMID: 18793147
- La fosfolipasa A2 beta independiente del calcio es prescindible en la activación del inflamasoma y su inhibición por la lactona de bromoenol. | Franchi, L., et al. 2009. J Innate Immun. 1: 607-17. PMID: 20160900
- Caracterización de células de mesotelioma I-45 adaptadas a bortezomib. | Zhang, L., et al. 2010. Mol Cancer. 9: 110. PMID: 20482802
- La acumulación de proteínas poliubiquitiladas en respuesta a la Ala-Ala-Phe-clorometilcetona es independiente de la inhibición de la Tripeptidil peptidasa II. | Villasevil, EM., et al. 2010. Biochim Biophys Acta. 1803: 1094-105. PMID: 20553980
- El inhibidor semiespecífico de TPPII Ala-Ala-Phe-clorometilcetona (AAF-cmk) muestra actividad citotóxica por inducción de apoptosis, autofagia y agregación de proteínas en células U937. | Bialy, LP., et al. 2018. Folia Histochem Cytobiol. 56: 185-194. PMID: 30294774
- Un cribado de alto contenido identifica TPP1 y Aurora B como reguladores del transporte mitocondrial axonal. | Shlevkov, E., et al. 2019. Cell Rep. 28: 3224-3237.e5. PMID: 31533043
- Purificación y caracterización de una tripeptidil aminopeptidasa I de bazo de rata. | Vines, D. and Warburton, MJ. 1998. Biochim Biophys Acta. 1384: 233-42. PMID: 9659384
- Una proteasa gigante con potencial para sustituir algunas funciones del proteasoma. | Geier, E., et al. 1999. Science. 283: 978-81. PMID: 9974389
Información sobre pedidos
| Nombre del producto | Número de catálogo | UNIDAD | Precio | CANTIDAD | Favoritos | |
AAF-CMK, 5 mg | sc-205591 | 5 mg | $94.00 | |||
AAF-CMK, 25 mg | sc-205591A | 25 mg | $317.00 |
