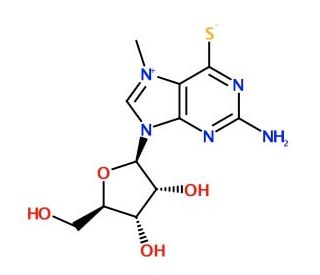
Estructura molecular de 7-Methyl-6-thioguanosine, Número CAS: 55727-10-1
7-Methyl-6-thioguanosine (CAS 55727-10-1)
Nombres Alternativos:
MESG
Solicitud:
7-Methyl-6-thioguanosine se utiliza en ensayos de fosfatos
Número de CAS:
55727-10-1
Peso Molecular:
313.33
Fórmula Molecular:
C11H15N5O4S
Para Uso Exclusivo en Investigación. No está diseñado para uso en diagnosis o terapia.
* En el Certificado de Análisis específico de lote, puede encontrar información específica (como el contenido en agua).
ENLACES RÁPIDOS
Información sobre pedidos
Descripción
Información Técnica
Información de Seguridad
SDS & Certificado de Análisis
7-Methyl-6-thioguanosine (MESG) forma 7-metil-6-tioguanina (Abs = 355 nm) en presencia de fosfato inorgánico y nucleósido fosforilasa (PNP), por lo tanto, es útil como un ensayo rápido y sensible para el fosfato. MESG es un sustrato cromóforo que también puede ser utilizado para detectar pirufosfato inorgánico. Además, se puede utilizar para medir los cambios en los niveles de fosfato inorgánico en sistemas de enzimas acopladas, incluyendo ensayos de las actividades de las fosfatasas de proteínas, cinasa fosforilasa, GTPasas y ATPasas.
7-Methyl-6-thioguanosine (CAS 55727-10-1) Referencias
- Un enfoque cinético para el estudio de la regulación de la actividad de la proteína cinasa catalizada por la proteína fosfatasa. | Wang, ZX., et al. 2002. Biochemistry. 41: 7849-57. PMID: 12056917
- La especificidad de la desfosforilación de la quinasa 2 regulada por señales extracelulares por las fosfatasas de proteínas. | Zhou, B., et al. 2002. J Biol Chem. 277: 31818-25. PMID: 12082107
- Caracterización de las interacciones entre la pequeña GTPasa RhoA y sus factores de intercambio de nucleótidos de guanina. | Tan, YC., et al. 2002. Anal Biochem. 310: 156-62. PMID: 12423633
- Medición de la actividad de la proteína fosfatasa con sustratos fisiológicos. | Zhou, B. and Zhang, ZY. 2003. Methods Enzymol. 366: 34-43. PMID: 14674237
- Estudios cinéticos y mecanísticos de una proteína fosfatasa Cdc14 del ciclo celular. | Wang, WQ., et al. 2004. J Biol Chem. 279: 30459-68. PMID: 15128740
- Estudio comparativo mecanístico y de especificidad de sustrato de la inositol polifosfato 5-fosfatasa Schizosaccharomyces pombe Synaptojanin y SHIP2. | Chi, Y., et al. 2004. J Biol Chem. 279: 44987-95. PMID: 15316017
- Actividad enzimática y especificidad de sustrato de la proteína cinasa activada por mitógenos p38alfa en diferentes estados de fosforilación. | Zhang, YY., et al. 2008. J Biol Chem. 283: 26591-601. PMID: 18669639
- Mecanismo molecular de inhibición de un componente crítico en las vías de transducción de señales del ácido abscísico de Arabidopsis thaliana, SnRK2.6, por la proteína fosfatasa ABI1. | Xie, T., et al. 2012. J Biol Chem. 287: 794-802. PMID: 22090030
- Análogos de intermedios de reacción como inhibidores bisubstratos de pantotenato sintetasa. | Xu, Z., et al. 2014. Bioorg Med Chem. 22: 1726-35. PMID: 24507827
- Catálisis por las enzimas supresoras de tumores PTEN y PTEN-L. | Johnston, SB. and Raines, RT. 2015. PLoS One. 10: e0116898. PMID: 25607987
- ARNm sintético capado para experimentos de fotoentrecruzamiento con capuchón específico. | Kowalska, J., et al. 2016. Methods Mol Biol. 1428: 31-43. PMID: 27236790
- Oligopéptidos de Mortierella alpina dirigidos a macrófagos. | Wurlitzer, JM., et al. 2022. Chem Sci. 13: 9091-9101. PMID: 36091214
- Ensayo espectrofotométrico continuo de las proteínas fosfatasas. | Cheng, Q., et al. 1995. Anal Biochem. 226: 68-73. PMID: 7785781
- Un método espectrofotométrico continuo para la determinación de la reacción catalizada por la glucógeno fosforilasa en la dirección de la síntesis del glucógeno. | Sergienko, EA. and Srivastava, DK. 1994. Anal Biochem. 221: 348-55. PMID: 7810877
- Ensayo espectrofotométrico continuo de la fosforilasa cinasa. | Wang, ZX., et al. 1995. Anal Biochem. 230: 55-61. PMID: 8585630
Información sobre pedidos
| Nombre del producto | Número de catálogo | UNIDAD | Precio | CANTIDAD | Favoritos | |
7-Methyl-6-thioguanosine, 10 mg | sc-221112 | 10 mg | $180.00 |
