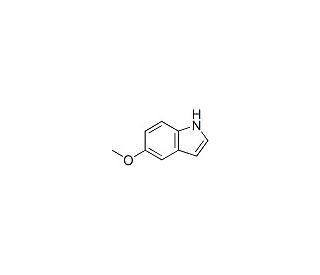
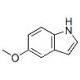
Estructura molecular de 5-Methoxyindole, Número CAS: 1006-94-6
5-Methoxyindole (CAS 1006-94-6)
Nombres Alternativos:
Femedol
Solicitud:
5-Methoxyindole es un compuesto metoxi indol simple
Número de CAS:
1006-94-6
Peso Molecular:
147.17
Fórmula Molecular:
C9H9NO
Para Uso Exclusivo en Investigación. No está diseñado para uso en diagnosis o terapia.
* En el Certificado de Análisis específico de lote, puede encontrar información específica (como el contenido en agua).
ENLACES RÁPIDOS
Información sobre pedidos
Descripción
Información Técnica
Información de Seguridad
SDS & Certificado de Análisis
El 5-metoxiindol es un compuesto metoxiindol simple. Al tener la estructura reducida de los indoles relevantes de la familia de las triptaminas, el 5-metoxiindol es un compuesto útil para la síntesis y la caracterización de las interacciones de las especies indólicas. El 5-metoxindol muestra un agonismo parcial en el receptor 5-HT3A y una actividad dual agonista/agonista inversa en el receptor 5-HT3B.
5-Methoxyindole (CAS 1006-94-6) Referencias
- Un procedimiento sencillo para la síntesis del roxindol, un agonista del receptor D2 de la dopamina. | Csende, F. 2001. Arch Pharm (Weinheim). 334: 253-4. PMID: 11512277
- La subunidad 5-HT3B confiere la apertura espontánea del canal y propiedades de ligando alteradas del receptor 5-HT3. | Hu, XQ. and Peoples, RW. 2008. J Biol Chem. 283: 6826-31. PMID: 18187416
- Espectroscopia electrónica rotacionalmente resuelta del 5-metoxindol. | Brand, C., et al. 2010. J Chem Phys. 133: 024303. PMID: 20632751
- Mecanismo para la síntesis directa de triptófano a partir de indol y serina: una técnica de RMN útil para la detección de un intermediario reactivo en la mezcla de reacción. | Yokoyama, Y., et al. 2010. Magn Reson Chem. 48: 811-7. PMID: 20799376
- Síntesis totales convergentes de los alcaloides de Amaryllidaceae licoranina A, licoranina B y 2-metoxipratosina. | Kim, HS., et al. 2013. J Org Chem. 78: 5103-9. PMID: 23607814
- Autoinhibición en un canal iónico activado por ligando: una interacción entre sitios ortostéricos y alostéricos. | Hu, XQ. 2015. Br J Pharmacol. 172: 93-105. PMID: 25176133
- Biotransformación del indol y sus derivados por una Enterobacter sp. M9Z aislada recientemente. | Qu, Y., et al. 2015. Appl Biochem Biotechnol. 175: 3468-78. PMID: 25725798
- Determinación de los momentos dipolares de los estados excitado y básico mediante espectroscopia electrónica de Stark: 5-metoxindol. | Wilke, J., et al. 2016. J Chem Phys. 144: 044201. PMID: 26827210
- Cambios conformacionales en el 5-metoxindol: Efectos de las excitaciones térmicas, vibracionales y electrónicas. | Lopes Jesus, AJ., et al. 2017. J Phys Chem A. 121: 3372-3382. PMID: 28409925
- Formación de radicales inducida por UV e isomerización de 4-metoxindol y 5-metoxindol. | Lopes Jesus, AJ., et al. 2020. Phys Chem Chem Phys. 22: 22943-22955. PMID: 33026378
- La melatonina y sus homólogos inducen respuestas inmunitarias a través de los receptores trP47363-trP13076 en Nicotiana benthamiana. | Kong, M., et al. 2021. Front Plant Sci. 12: 691835. PMID: 34276740
- Alcaloides del sapo para el descubrimiento de plaguicidas: Dehydrobufotenine Derivatives as Novel Agents against Plant Virus and Fungi. | Tian, Z., et al. 2021. J Agric Food Chem. 69: 9754-9763. PMID: 34415761
- El 5-metoxindol, un homólogo químico de la melatonina, afecta negativamente al hongo fitopatógeno Fusarium graminearum. | Kong, M., et al. 2021. Int J Mol Sci. 22: PMID: 34681652
Información sobre pedidos
| Nombre del producto | Número de catálogo | UNIDAD | Precio | CANTIDAD | Favoritos | |
5-Methoxyindole, 1 g | sc-202023 | 1 g | $36.00 | |||
5-Methoxyindole, 5 g | sc-202023A | 5 g | $118.00 |
