
Suc-LLVY-AMC
Direktverknüpfungen
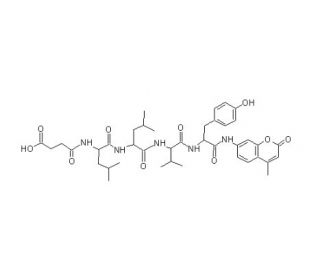
Suc-LLVY-AMC ist ein empfindliches fluorogenes Substrat für das 20S-Proteasom, Calpaine und andere chymotrypsin-ähnliche Proteasen. Das nicht fluoreszierende Substrat erzeugt ein hellblau fluoreszierendes AMC-Produkt mit Ex/Em = 351/430 nm, das leicht mit dem DAPI-Filter-Set nachgewiesen werden kann. Die häufigste Form des Proteasoms ist als 26S-Proteasom bekannt und enthält eine 20S-Kernpartikelstruktur sowie zwei 19S-Regulierungskappen. Alle 20S-Partikel bestehen aus vier gestapelten heptameren Ringstrukturen, die selbst aus zwei verschiedenen Arten von Untereinheiten bestehen: Alpha-Untereinheiten sind struktureller Natur, während Beta-Untereinheiten überwiegend katalytisch sind. Die äußeren beiden Ringe im Stapel bestehen jeweils aus sieben Alpha-Untereinheiten, die als Andockdomänen für die Regulierungspartikel dienen, und die N-Termini der Alpha-Untereinheiten bilden ein Tor, das den unregulierten Zugang von Substraten zur inneren Höhle blockiert. Die inneren beiden Ringe bestehen jeweils aus sieben Beta-Untereinheiten und enthalten die proteolytischen Aktivzentren, die die Proteolyse-Reaktionen durchführen. Suc-LLVY-AMC ist ein synthetisches Peptid-Substrat, das häufig in biochemischen und enzymatischen Assays verwendet wird, um die Aktivität von Proteasom-Enzymen zu messen. Der Name "Suc-LLVY-AMC" steht für Succinyl-Leu-Leu-Val-Tyr-7-amino-4-methylcoumarin, was die Sequenz und Struktur des Substrats repräsentiert.
Suc-LLVY-AMC Literaturhinweise
- Reinigung und Charakterisierung eines Proteininhibitors des 20S-Proteasoms (Macropain). | Chu-Ping, M., et al. 1992. Biochim Biophys Acta. 1119: 303-11. PMID: 1312359
- Die Rolle des Ginsenosids Rd bei der Hemmung der 26S-Proteasom-Aktivität. | Chang, TL., et al. 2008. J Agric Food Chem. 56: 12011-5. PMID: 19053398
- Wirkung der nichtkompetitiven Proteasom-Hemmung auf die Bortezomib-Resistenz. | Li, X., et al. 2010. J Natl Cancer Inst. 102: 1069-82. PMID: 20505154
- Veränderungen im Proteasom-Pool während der malignen Transformation von Mausleberzellen. | Astakhova, TM., et al. 2010. Acta Naturae. 2: 102-8. PMID: 22649635
- Proteasomfunktion bei Brustkrebs: Zusammenhang mit klinisch-pathologischen Faktoren. | Shashova, EE., et al. 2014. PLoS One. 9: e109933. PMID: 25329802
- Überschneidungen zwischen dem Autophagie-Lysosom-Weg und dem Ubiquitin-Proteasom-Weg in retinalen Pigmentepithelzellen. | Zhan, J., et al. 2016. Curr Mol Med. 16: 487-95. PMID: 27132793
- ABA-abhängige Hemmung des Ubiquitin-Proteasom-Systems während der Keimung bei hoher Temperatur in Arabidopsis. | Chiu, RS., et al. 2016. Plant J. 88: 749-761. PMID: 27496613
- Wirkung von Ferulasäure, einem Phenol, das die Laccase von Pilzen induziert, auf die 26S-Proteasom-Aktivitäten in vitro. | Swatek, A. and Staszczak, M. 2020. Int J Mol Sci. 21: PMID: 32252291
- Erforschung des Proteolyse-Mechanismus der Proteasomen. | Saha, A., et al. 2020. J Phys Chem B. 124: 5626-5635. PMID: 32498514
- Proteasom-Aktivität im Plasma als neuartiger Biomarker bei leichter kognitiver Beeinträchtigung mit chronischem Tinnitus. | Yun, Y., et al. 2020. J Alzheimers Dis. 78: 195-205. PMID: 32955464
- Proteasomen bei Patienten mit Rektumkarzinom und an verschiedenen Stellen des Darms: Wo verändert sich der Proteasomen-Pool? | Erokhov, PA., et al. 2021. Cancers (Basel). 13: PMID: 33807574
- Verminderte proteasomale Spaltung an Nitrotyrosinstellen in Proteinen und Peptiden. | Ott, C., et al. 2021. Redox Biol. 46: 102106. PMID: 34455147
- Plasma-Exosomen von Patientinnen mit Brust- und Eierstocktumoren enthalten ein inaktives 20S-Proteasom. | Yunusova, N., et al. 2021. Molecules. 26: PMID: 34834058
- Das α-Mangostin-Derivat 4e als PDE4-Inhibitor fördert den proteasomalen Abbau von Alpha-Synuclein in Parkinson-Modellen durch PKA-Aktivierung. | Chen, JY., et al. 2022. Phytomedicine. 101: 154125. PMID: 35525236
- Strukturelle Untersuchung der Proteasominhibition. | Ditzel, L., et al. 1997. Biol Chem. 378: 239-47. PMID: 9165077
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Suc-LLVY-AMC, 1 mg | sc-495769 | 1 mg | $131.00 |
