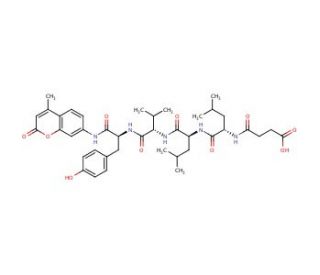
Suc-Leu-Leu-Val-Tyr-AMC (CAS 94367-21-2)
Produktreferenzen ansehen (3)
Direktverknüpfungen
Suc-Leu-Leu-Val-Tyr-AMC ist ein fluoreszierendes Peptidsubstrat, das häufig in der Biochemie und Molekularbiologie zur Bestimmung und Charakterisierung von Proteaseaktivität, insbesondere der Proteasomen, verwendet wird. Diese Proteine sind für die Abbau unerwünschter oder beschädigter Proteine durch Proteolyse verantwortlich. Dieses Substrat ist so konzipiert, dass es bei der Cleavage durch die anvisierte Protease ein fluoreszierendes Produkt freisetzt, was es Forschern ermöglicht, die Proteaseaktivität in Echtzeit mit hoher Empfindlichkeit zu überwachen. Die Verwendung solcher Substrate erleichtert die Untersuchung der Enzymkinetik und das Verständnis der Proteaseregulierung in verschiedenen zellulären Prozessen, einschließlich des Ubiquitin-Proteasom-Pfades, der für die Proteinhomöostase innerhalb der Zelle entscheidend ist. Durch die Bereitstellung einer quantifizierbaren Ausgabe hilft Suc-Leu-Leu-Val-Tyr-AMC bei der Identifizierung von Faktoren, die die Proteasefunktion beeinflussen, und bei der Charakterisierung der Spezifität und Effizienz von Proteasomenenzymen.
Suc-Leu-Leu-Val-Tyr-AMC (CAS 94367-21-2) Literaturhinweise
- Charakterisierung von Peptidylboronsäure-Inhibitoren von 20 S- und 26 S-Proteasomen von Säugetieren und deren Hemmung von Proteasomen in kultivierten Zellen. | Gardner, RC., et al. 2000. Biochem J. 346 Pt 2: 447-54. PMID: 10677365
- Wasser moduliert die Aktivität der chymotryptischen Enzyme des Stratum corneum und die Abschuppung. | Watkinson, A., et al. 2001. Arch Dermatol Res. 293: 470-6. PMID: 11758790
- Menschliches Thrombozyten-20S-Proteasom: Hemmung seiner Chymotrypsin-ähnlichen Aktivität und Identifizierung des Proteasom-Aktivators PA28. Ein vorläufiger Bericht. | Ostrowska, H., et al. 2003. Platelets. 14: 151-7. PMID: 12850839
- Identifizierung, Reinigung und Charakterisierung eines Proteinaktivators (PA28) des 20-S-Proteasoms (Macropain). | Ma, CP., et al. 1992. J Biol Chem. 267: 10515-23. PMID: 1587832
- Ortsspezifischer Abbau des myelinbasischen Proteins durch das Proteasom. | Belogurov, AA., et al. 2009. Dokl Biochem Biophys. 425: 68-72. PMID: 19496324
- Wirkung des Substrats auf die Ca2(+)-Konzentration, die für die Aktivität der Ca2(+)-abhängigen Proteinasen mu- und m-Calpain erforderlich ist. | Barrett, MJ., et al. 1991. Life Sci. 48: 1659-69. PMID: 2016996
- Die Wechselwirkung zwischen Calpain-Aktivierung und TGF-β1 steigert die Kollagen-I-Synthese bei Lungenfibrose. | Li, FZ., et al. 2015. Biochim Biophys Acta. 1852: 1796-804. PMID: 26071646
- Die Protease Ti aus Escherichia coli benötigt ATP-Hydrolyse für den Proteinabbau, aber nicht für die Hydrolyse kleiner Peptide. | Woo, KM., et al. 1989. J Biol Chem. 264: 2088-91. PMID: 2644253
- Die erste Charakterisierung eines eubakteriellen Proteasoms: der 20S-Komplex von Rhodococcus. | Tamura, T., et al. 1995. Curr Biol. 5: 766-74. PMID: 7583123
- Beweise für das Vorhandensein von Chymotrypsin-ähnlicher Aktivität in menschlichen Spermien, die eine Rolle bei der Akrosom-Reaktion spielen. | Morales, P., et al. 1994. Mol Reprod Dev. 38: 222-30. PMID: 8080652
- Mechanistische Studien über die Inaktivierung des Proteasoms durch Lactacystin: eine zentrale Rolle für Clasto-Lactacystin-Beta-Lacton. | Dick, LR., et al. 1996. J Biol Chem. 271: 7273-6. PMID: 8631740
- Kinetische Charakterisierung der chymotryptischen Aktivität des 20S-Proteasoms. | Stein, RL., et al. 1996. Biochemistry. 35: 3899-908. PMID: 8672420
- Die Phosphorylierung des Proteasom-Aktivators PA28 ist für die Proteasom-Aktivierung erforderlich. | Li, N., et al. 1996. Biochem Biophys Res Commun. 225: 855-60. PMID: 8780702
- Induktion des mitochondrialen Permeabilitätsübergangs als Mechanismus der Leberschädigung während der Cholestase: eine mögliche Rolle für mitochondriale Proteasen. | Gores, GJ., et al. 1998. Biochim Biophys Acta. 1366: 167-75. PMID: 9714791
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Suc-Leu-Leu-Val-Tyr-AMC, 5 mg | sc-471159 | 5 mg | $148.00 | |||
Suc-Leu-Leu-Val-Tyr-AMC, 25 mg | sc-471159A | 25 mg | $490.00 | |||
Suc-Leu-Leu-Val-Tyr-AMC, 100 mg | sc-471159B | 100 mg | $1530.00 |
