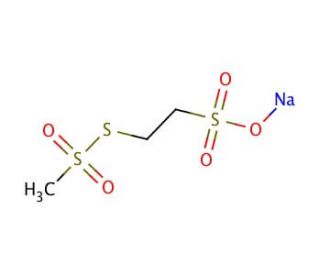
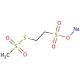
Sodium (2-Sulfonatoethyl)methanethiosulfonate (CAS 184644-83-5)
Produktreferenzen ansehen (1)
Direktverknüpfungen
Natrium(2-Sulfonatoethyl)methanethiosulfonat ist eine Sonde für GABAA-Rezeptorkanäle. Als Methanethiosulfonat ist Natrium(2-Sulfonatoethyl)methanethiosulfonat sulfhydryl-reaktiv und kann zur Untersuchung von Cysteinresten auf Proteinen verwendet werden. Natrium(2-Sulfonatoethyl)methanthiosulfonat reagiert spezifisch und schnell mit Thiolen und bildet gemischte Disulfide. Natrium-(2-Sulfonatoethyl)methanethiosulfonat untersucht die Strukturen des ACh-Rezeptorkanals, des GABAA-Rezeptorkanals und der Laktosepermease. Natrium(2-Sulfonatoethyl)methanethiosulfonat ist besonders wirksam bei der Untersuchung nativer Proteine, die mit Membranen verbunden sind, wie Kanäle und Transporter.
Sodium (2-Sulfonatoethyl)methanethiosulfonate (CAS 184644-83-5) Literaturhinweise
1. Dunten, R.L., et al.: Biochem., 32, 3139 (1993),2. Yang, N. et al.: Neuron, 16, 113 (1996),
3. Holmgren, M., et al: Neuropharmacology, 35, 797 (1996),
4. Chahine, M., et al.: Biochem. Bio. Res. Commun., 233, 606 (1997),
5. Ehrlich, B.E., et al.: J. Gen. Physiol., 109, 255 (1997),
6. Lang, R.J., Harvey, J.R., and Mulholland, E.L.Sodium (2-sulfonatoethyl) methanethiosulfonate prevents S-nitroso-L-cysteine activation of Ca2+-activated K+ (BKCa) channels in myocytes of the guinea-pig taenia caeca. Br. J. Pharmacol. 139(6), 1153-1163 (2003).
7. Li, R.A., Tsushima, R.G., Kallen, R.G., et al.Pore residues critical for μ-CTX binding to rat skeletal muscle Na+ channels revealed by cysteine mutagenesis. Biophys. J. 73(4), 1874-1884 (1997).
8. Guan, L., and Kaback, H.R.Site-directed alkylation of cysteine to test solvent accessibility of membrane proteins. Nature Protocols 2(8), 2012-2017 (2007).
9. Engh, A.M., and Maduke, M.Cysteine accessibility in ClC-0 supports conservation of the ClC intracellular vestibule. Journal of General Physiology 125(6), 601-617 (2014).
10. Liu, X., Alexander, C., Serrano, J., et al.Variable reactivity of an engineered cysteine at position 338 in cystic fibrosis transmembrane conductance regulator reflects different chemical states of the thiol. The Journal of Biological Chemisty 281(12), 8275-8285 (2006).
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Sodium (2-Sulfonatoethyl)methanethiosulfonate, 250 mg | sc-212933 | 250 mg | $370.00 |
