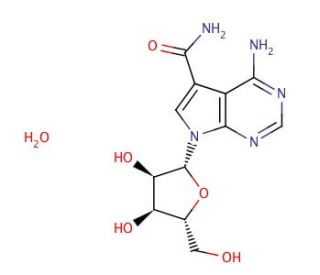
Molekülstruktur von Sangivamycin, CAS-Nummer: 18417-89-5
Sangivamycin (CAS 18417-89-5)
Alternative Namen:
7-Deaza-7-carbamoyladenosine
Anwendungen:
Sangivamycin ist ein zytotoxisches Purinnukleosid
CAS Nummer:
18417-89-5
Molekulargewicht:
309.3
Summenformel:
C12H15N5O5
Ergänzende Informationen:
Dieses Produkt wird als Gefahrgut eingestuft und unterliegt möglicherweise zusätzlichen Versandkosten.
Ausschließlich für Forschungszwecke. Nicht Geeignet für Verwendung in Diagnostik oder Therapie.
* Schauen Sie auf das Analysezertifikat (CoA), um die genauen Daten (inkl. Wassergehalt) Ihrer Produktionscharge (Lot) zu sehen.
Direktverknüpfungen
Bestellinformation
Beschreibung
Hintergrundinformationen
Sicherheitshinweis
SDS (SDB) & Analysenzertifikate
Sangivamycin ist ein zytotoxisches Purin-Nukleosid, das gegen das humane Zytomegalievirus (HCMV) wirksam ist. Es ist auch ein selektiver und potenter PKC (Proteinkinase C) Inhibitor (IC50 = 10 µM). Die Hemmung ist kompetitiv in Bezug auf ATP und nicht-kompetitiv in Bezug auf Histone und Lipid-Kofaktoren. Die Phosphorylierung des Histone H1 Proteins ist ein Mechanismus, durch den Sangivamycin das Zellwachstum verhindert und als zytotoxisches Mittel gegen eine Vielzahl von menschlichen Krebsarten wirkt.
Sangivamycin (CAS 18417-89-5) Literaturhinweise
- Synthese von Pyrrolo[2,1-f][1,2,4]triazin-C-Nukleosiden. Isostere von Sangivamycin, Tubercidin und Toyocamycin. | Nishimura, N., et al. 2001. Carbohydr Res. 331: 77-82. PMID: 11284507
- Das Nukleosidanalogon Sangivamycin induziert den apoptotischen Zelltod in Brustkrebszellen MCF7/Adriamycin-resistenten Zellen durch Aktivierung der Proteinkinase Cdelta und JNK. | Lee, SA. and Jung, M. 2007. J Biol Chem. 282: 15271-83. PMID: 17371872
- Hemmung der Tumorangiogenese durch gezielte Beeinflussung der ATP-Synthase auf der Endotheloberfläche mit Sangivamycin. | Komi, Y., et al. 2007. Jpn J Clin Oncol. 37: 867-73. PMID: 17956898
- ARC (NSC 188491) hat die gleiche Wirkung wie Sangivamycin (NSC 65346) und hemmt sowohl P-TEFb als auch PKC. | Stockwin, LH., et al. 2009. BMC Cancer. 9: 63. PMID: 19232100
- Sangivamycin induziert Apoptose durch Unterdrückung der Erk-Signalübertragung in primären Erguss-Lymphomzellen. | Wakao, K., et al. 2014. Biochem Biophys Res Commun. 444: 135-40. PMID: 24434142
- Vergleich der zellulären und RNA-abhängigen Wirkungen von Sangivamycin und Toyocamycin in menschlichen Kolonkarzinomzellen. | Cohen, MB. and Glazer, RI. 1985. Mol Pharmacol. 27: 349-55. PMID: 2579317
- Synthese, Zytotoxizität und antivirale Aktivität einiger azyklischer Analoga der Pyrrolo[2,3-d]pyrimidin-Nukleosid-Antibiotika Tubercidin, Toyocamycin und Sangivamycin. | Gupta, PK., et al. 1989. J Med Chem. 32: 402-8. PMID: 2913300
- Eine neue biologische Rolle von Sangivamycin: Hemmung von Proteinkinasen. | Osada, H., et al. 1989. J Antibiot (Tokyo). 42: 102-6. PMID: 2921215
- Pyrrolo[2,3-d]pyrimidin-Nukleoside als Inhibitoren des menschlichen Cytomegalovirus. | Turk, SR., et al. 1987. Antimicrob Agents Chemother. 31: 544-50. PMID: 3037998
- Sangivamycin und seine Derivate hemmen die Haspin-Histon H3-Survivin-Signalübertragung und induzieren den Zelltod bei Bauchspeicheldrüsenkrebs. | Bastea, LI., et al. 2019. Sci Rep. 9: 16588. PMID: 31719634
- Sangivamycin, ein Nukleosidanalogon, ist ein starker Hemmstoff der Proteinkinase C. | Loomis, CR. and Bell, RM. 1988. J Biol Chem. 263: 1682-92. PMID: 3338987
- Sangivamycin ist in vitro hochwirksam gegen SARS-CoV-2 und hat günstige Arzneimitteleigenschaften. | Bennett, RP., et al. 2022. JCI Insight. 7: PMID: 34807849
- Nukleinsäureverwandte Verbindungen. 51. Synthese und biologische Eigenschaften von zuckermodifizierten Analoga der Nukleosid-Antibiotika Tubercidin, Toyocamycin, Sangivamycin und Formycin. | De Clercq, E., et al. 1987. J Med Chem. 30: 481-6. PMID: 3820218
- Pyrrolo[2,3-d]pyrimidin-Nukleosid-Antibiotika. Totalsynthese und Struktur von Toyocamycin, Unamycin B, Vengizid, Antibiotikum E-212 und Sangivamycin (BA-90912). | Tolman, RL., et al. 1968. J Am Chem Soc. 90: 524-6. PMID: 5634627
- Kinetik und Lokalisierung der Phosphorylierung von Rhodopsin durch Proteinkinase C. | Greene, NM., et al. 1995. J Biol Chem. 270: 6710-7. PMID: 7896814
Inhibitor von:
ARPP-21, DERA, PKC, Ribosomal Protein L10a, Ser/Thr Protein Kinase, und U1 snRNP 70.Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Sangivamycin, 1 mg | sc-204261 | 1 mg | $333.00 | |||
Sangivamycin, 10 mg | sc-204261A | 10 mg | $1348.00 | |||
Sangivamycin, 25 mg | sc-204261B | 25 mg | $2611.00 | |||
Sangivamycin, 50 mg | sc-204261C | 50 mg | $5212.00 | |||
Sangivamycin, 100 mg | sc-204261D | 100 mg | $9894.00 | |||
Sangivamycin, 250 mg | sc-204261E | 250 mg | $20298.00 |
