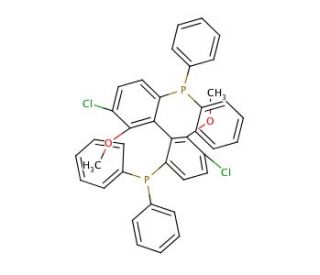
(S)-(−)-Cl-MeO-BIPHEP (CAS 185913-98-8)
Direktverknüpfungen
(S)-(-)-Cl-MeO-BIPHEP ist ein chiraler Phosphinligand, der als Katalysator für asymmetrische Synthesen verwendet werden kann. Er kann bei katalytischen Reaktionen effizient und selektiv wirken, mit hohen Ausbeuten und Enantioselektivität. Die asymmetrische Katalyse ist ein Eckpfeiler der modernen synthetischen organischen Chemie, insbesondere in der Feinchemie, wo die Herstellung einzelner Enantiomere von Molekülen aufgrund der unterschiedlichen biologischen Aktivität der verschiedenen Enantiomere häufig erforderlich ist. Der Ligand wird unter anderem bei asymmetrischen Hydrierungsreaktionen eingesetzt, wo er bei der Reduktion einer Vielzahl von Substraten wie Ketonen, Iminen und ungesättigten Kohlenstoff-Kohlenstoff-Bindungen helfen kann, wobei chirale Alkohole, Amine und andere Verbindungen mit hoher Enantioselektivität entstehen. (S)-(-)-Cl-MeO-BIPHEP katalysiert die Allylierung von verschiedenen substituierten Styrolen sowie die regiospezifische Bildung von Polyketiden.
(S)-(−)-Cl-MeO-BIPHEP (CAS 185913-98-8) Literaturhinweise
- Erste katalytische reduktive Kupplung von 1,3-Diinen an Carbonylpartner: eine neue regio- und enantioselektive C-C-Bindung bildende Hydrierung. | Huddleston, RR., et al. 2003. J Am Chem Soc. 125: 11488-9. PMID: 13129338
- Phosphin-katalysierte regiospezifische allylische Aminierung und dynamische kinetische Auflösung von Morita-Baylis-Hillman-Acetaten. | Cho, CW., et al. 2004. Org Lett. 6: 1337-9. PMID: 15070331
- Kupfer-katalysierte asymmetrische propargylische Substitutionsreaktionen von propargylischen Acetaten mit Aminen. | Hattori, G., et al. 2008. Angew Chem Int Ed Engl. 47: 3781-3. PMID: 18404748
- Kupfer-katalysierte enantioselektive propargylische Aminierung von propargylischen Estern mit Aminen: Kupfer-Alenylidenkomplexe als Schlüsselintermediate. | Hattori, G., et al. 2010. J Am Chem Soc. 132: 10592-608. PMID: 20617844
- Enantioselektive Pd-katalysierte Hydrierung von fluorierten Iminen: einfacher Zugang zu chiralen fluorierten Aminen. | Chen, MW., et al. 2010. Org Lett. 12: 5075-7. PMID: 20919725
- Rhodium-katalysierte Cyclisierung von Diinen mit Nitronen: ein formaler [2+2+5]-Ansatz für verbrückte achtgliedrige Heterocyclen. | Wang, C., et al. 2014. Angew Chem Int Ed Engl. 53: 11940-3. PMID: 25220662
- Kupfer-katalysierte diastereo- und enantioselektive Folgereaktionen von Propargyl Acetaten mit (E)-2,4-Pentadienylamin | Gaku Hattori, Yoshihiro Miyake Dr., Yoshiaki Nishibayashi Prof. Dr. 2010. ChemCatChem. 2: 155-158.
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
(S)-(−)-Cl-MeO-BIPHEP, 1 g | sc-236560 | 1 g | $709.00 |
