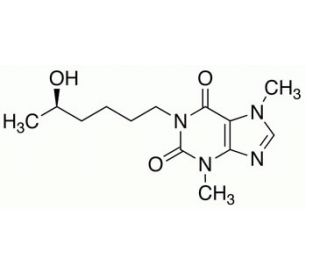
(R)-Lisofylline (CAS 100324-81-0)
Direktverknüpfungen
(R)-Lisofyllin ist ein Immunmodulator und ein Hauptmetabolit von Pentoxifyllin und Methylxanthin. (R)-Lisofyllin hemmt die Produktion von Phosphatidinsäure während der Entzündungsreaktion. (R)-Lisofyllin, ein synthetisches Medikament mit antiinflammatorischen und antioxidativen Eigenschaften, wurde in den letzten zehn Jahren intensiv untersucht. Es stammt aus dem natürlichen Verbindungsstoff Lisofyllin, der ein Glykosid von Lysin, einer Aminosäure, ist. Die potenziellen Anwendungsmöglichkeiten des Medikaments zur Behandlung verschiedener entzündlicher und oxidativ-vermittelter Krankheiten wurden gründlich untersucht. Insbesondere wurde seine Fähigkeit, Entzündungen und oxidative Stress im Gehirn, Herz und anderen Organen zu mildern, untersucht.
(R)-Lisofylline (CAS 100324-81-0) Literaturhinweise
- Koffeinanaloga: Biomedizinische Auswirkungen. | Daly, JW. 2007. Cell Mol Life Sci. 64: 2153-69. PMID: 17514358
- Die Serum-Metabolomstudie der Interventionseffekte der traditionellen chinesischen Medizin Shexiang Baoxin Pill und einer Mehrkomponenten-Medizin Polypill bei der Behandlung von Myokardinfarkt bei Ratten. | Xiang, L., et al. 2012. Mol Biosyst. 8: 2434-42. PMID: 22791014
- Eine entfernte Estergruppe führt zu einer effizienten kinetischen Auflösung von racemischen aliphatischen Alkoholen durch asymmetrische Hydrierung. | Yang, XH., et al. 2014. J Am Chem Soc. 136: 17426-9. PMID: 25437900
- Bor-katalysierte regioselektive Desoxygenierung von endständigen 1,2-Diolen zu 2-Alkanolen, ermöglicht durch die strategische Bildung eines zyklischen Siloxan-Zwischenprodukts. | Drosos, N. and Morandi, B. 2015. Angew Chem Int Ed Engl. 54: 8814-8. PMID: 26089307
- Active Site Crowding von Cytochrom P450 3A4 als Strategie zur Veränderung seiner Selektivität. | Schiavini, P., et al. 2017. Chembiochem. 18: 248-252. PMID: 27897366
- Anwendung der Metabolomik zur Entdeckung der therapeutischen Rolle der traditionellen chinesischen Medizin bei Stoffwechselkrankheiten. | Wu, G., et al. 2019. J Ethnopharmacol. 242: 112057. PMID: 31279867
- Quantitative Bewertung des Beitrags der einzelnen Aldo-Keto-Reduktase- und kurzkettigen Dehydrogenase/Reduktase-Isoformen zu Reduktionsreaktionen von Verbindungen, die eine Ketongruppe enthalten, in der menschlichen Leber. | Ichida, H., et al. 2023. Drug Metab Dispos. 51: 17-28. PMID: 36310032
- Hocheffiziente asymmetrische Hydrierung, katalysiert durch Iridium-Komplexe mit dreizähnigen chiralen Spiro-Aminophosphin-Liganden. | Yang, F., et al. 2023. Acc Chem Res. 56: 332-349. PMID: 36689780
- Chemoenzymatische enantioselektive und stereokonvergente Synthesen von Lisofyllin-Enantiomeren durch Lipase-katalysierte kinetische Auflösung und optische Inversion | Borowiecki, P., Zdun, B., & Dranka, M. 2021. Molecular Catalysis. 504: 111451.
- Chemoenzymatische Deracemisierung von Lisofyllin, katalysiert durch ein (Laccase/TEMPO)-Alkohol-Dehydrogenase-System | Borowiecki, P., Rudzka, A., Reiter, T., & Kroutil, W. 2022. Catalysis Science & Technology. 12(13): 4312-4324.
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
(R)-Lisofylline, 2 mg | sc-208243 | 2 mg | $286.00 |
