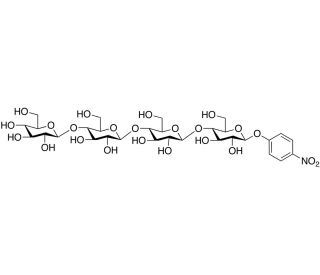
p-Nitrophenyl β-D-Cellotetraoside (CAS 129411-62-7)
Direktverknüpfungen
p-Nitrophenyl-β-D-Cellotetraosid ist ein synthetisches Glykosid, das in der Enzymologie häufig zur Untersuchung der Aktivität und Spezifität von Cellulasen, Enzymen, die Cellulose abbauen, verwendet wird. Diese Verbindung besteht aus einer p-Nitrophenylgruppe, die an eine β-D-Cellotetraose, ein Cellulose-Oligomer, gebunden ist, das als Substratnachahmung für Cellulasen dient, die am Abbau von Cellulosematerialien beteiligt sind. Die p-Nitrophenylgruppe fungiert als chromophorer Reporter, der bei enzymatischer Spaltung p-Nitrophenol freisetzt. Die Freisetzung dieses Moleküls kann quantitativ durch seine Absorption bei 405 nm gemessen werden, was eine einfache Methode zur Überwachung der Enzymkinetik und -aktivität darstellt. Diese Eigenschaft macht p-Nitrophenyl-β-D-Cellotetraosid besonders wertvoll für die Untersuchung der Cellulase-Aktivität in verschiedenen Forschungszusammenhängen, einschließlich Studien zum Verständnis des enzymatischen Abbaus von Biomasse und der Optimierung industrieller Prozesse wie der Biokraftstoffproduktion. Die Forschung mit dieser Verbindung hilft, die Mechanismen aufzuklären, mit denen Cellulasen ihre Cellulosesubstrate erkennen und spalten, und trägt so zu Fortschritten in der Biotechnologie und Umweltwissenschaft bei. Durch das Verständnis der spezifischen Wechselwirkungen zwischen Enzym und Substrat können Wissenschaftler effizientere Enzyme für die Umwandlung von Zellulose in fermentierbare Zucker entwickeln und so die Nachhaltigkeit und Effizienz von Biokraftstoffproduktionsverfahren verbessern. Diese Chemikalie spielt somit eine entscheidende Rolle in der Grundlagenforschung zur Verbesserung der Nutzung erneuerbarer Ressourcen.
p-Nitrophenyl β-D-Cellotetraoside (CAS 129411-62-7) Literaturhinweise
- Isolierung und Analyse von zwei Cellulase-cDNAs aus Orpinomyces joyonii. | Qiu, X., et al. 2000. Gene. 245: 119-26. PMID: 10713452
- Biochemische Charakterisierung und Wirkungsmechanismus einer thermostabilen Beta-Glucosidase, die aus Thermoascus aurantiacus gereinigt wurde. | Parry, NJ., et al. 2001. Biochem J. 353: 117-127. PMID: 11115405
- Eine neue alkalische Endoglucanase aus einem alkaliphilen Bacillus-Isolat: enzymatische Eigenschaften sowie Nukleotid- und abgeleitete Aminosäuresequenzen. | Endo, K., et al. 2001. Appl Microbiol Biotechnol. 57: 109-16. PMID: 11693906
- Eine neu beschriebene cellulosomale Cellobiohydrolase, CelO, aus Clostridium thermocellum: Untersuchung des Exo-Modus der Hydrolyse und der Bindungsfähigkeit an kristalline Cellulose. | Zverlov, VV., et al. 2002. Microbiology (Reading). 148: 247-255. PMID: 11782517
- Enzymatische Eigenschaften, Kristallisation und abgeleitete Aminosäuresequenz einer alkalischen Endoglucanase aus Bacillus circulans. | Hakamada, Y., et al. 2002. Biochim Biophys Acta. 1570: 174-80. PMID: 12020807
- Molekulare Klonierung und Charakterisierung eines Cellulase-Gens aus einem symbiotischen Protisten der Niederen Termite, Coptotermes formosanus. | Inoue, T., et al. 2005. Gene. 349: 67-75. PMID: 15777663
- Transcellobiosylierungsreaktionen, katalysiert durch verschiedene Exoglucanase-Komponenten einer Trichoderma viride Cellulase in wässrigem organischem Lösungsmittel | Hayashi, Y., Kitayaki, M., Takezaki, K., Ikeuchi, H., & Kunugi, S. 2003. Biocatalysis and Biotransformation. 21(1): 25-31.
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
p-Nitrophenyl β-D-Cellotetraoside, 1 mg | sc-222113 | 1 mg | $265.00 |
