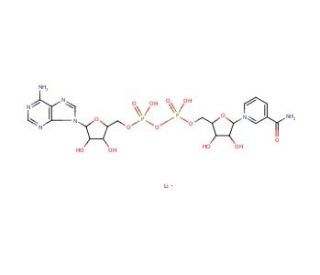
NAD+, Lithium Salt (CAS 64417-72-7)
Direktverknüpfungen
NAD+, Lithiumsalz ist eine Variante des Nicotinamidadenindinukleotids, bei der Lithiumionen verwendet werden, um die negative Ladung des NAD+-Moleküls zu neutralisieren. In der Forschung ist diese Salzform besonders nützlich bei enzymatischen Reaktionen und Studien, die Dehydrogenasen einbeziehen, da es als Coenzym für Redoxreaktionen unerlässlich ist. NAD+, Lithiumsalz wird zur Untersuchung von Stoffwechselwegen und Energieproduktion verwendet, da es an der Elektronentransportkette innerhalb der zellulären Mitochondrien beteiligt ist. Es ist auch bei Studien zur DNA-Reparatur von Bedeutung, aufgrund seiner Rolle als Substrat für ADP-Ribosyltransferasen. Darüber hinaus nutzen Forscher NAD+, Lithiumsalz in Assays zur Messung der Aktivität von Sirtuinen und PARPs, die wichtig sind für das Verständnis der zellulären Regulation, Stressreaktionen und die Aufrechterhaltung der genomischen Stabilität.
NAD+, Lithium Salt (CAS 64417-72-7) Literaturhinweise
- Enzymregulierung durch reversible Zinkhemmung: Glycerinphosphatdehydrogenase als Beispiel. | Maret, W., et al. 2001. Chem Biol Interact. 130-132: 891-901. PMID: 11306104
- IFCC primäre Referenzverfahren für die Messung der katalytischen Aktivitätskonzentrationen von Enzymen bei 37 Grad C. Teil 3. Referenzverfahren für die Messung der katalytischen Konzentration von Lactatdehydrogenase. | Schumann, G., et al. 2002. Clin Chem Lab Med. 40: 643-8. PMID: 12211663
- Bestimmung von l- und d-Laktat in realen Milchproben mit immobilisierten Enzymreaktoren und Graphitelektroden. | Marrazza, G., et al. 1994. Talanta. 41: 1007-14. PMID: 18966029
- IFCC-Referenzverfahren für die Messung der katalytischen Konzentrationen von Enzymen: Berichtigung, Anmerkungen und nützliche Hinweise. Internationaler Verband für klinische Chemie und Laboratoriumsmedizin (IFCC)--IFCC Scientific Division. | Schumann, G., et al. 2010. Clin Chem Lab Med. 48: 615-21. PMID: 20298135
- Untersuchung der Laktatdehydrogenase-Aktivität in Tumoren durch Messung des Wasserstoff/Deuterium-Austauschs in hyperpolarisiertem l-[1-(13)C,U-(2)H]Laktat. | Kennedy, BW., et al. 2012. J Am Chem Soc. 134: 4969-77. PMID: 22316419
- Umkehrung eines Teils des Aldehyd-Dehydrogenase-Reaktionsweges während der Hydrolyse eines Esters. | Duncan, RJ. 1979. Biochem J. 183: 459-62. PMID: 230823
- PEGylierte Sauerstoffträger mit hoher und niedriger Affinität auf Hämoglobinbasis: Unterschiedlicher oxidativer Stress in einem Meerschweinchen-Transfusionsmodell. | Alomari, E., et al. 2018. Free Radic Biol Med. 124: 299-310. PMID: 29920341
- Struktur von Adenosin-5'-mononicotinat (AMN) Trihydrat: ein Analogon von NAD zur Untersuchung der intramolekularen Stapelung. | Ramasubbu, N. and Parthasarathy, R. 1988. Acta Crystallogr C. 44 (Pt 12): 2140-4. PMID: 3270554
- Simvastatin beeinträchtigt die Glukose-Homöostase bei Mäusen in Abhängigkeit von der PGC-1α-Expression in der Skelettmuskulatur. | Panajatovic, MV., et al. 2020. Biomedicines. 8: PMID: 32942550
- Modifikation der Laktatdehydrogenase im Hoden der Maus durch Pyridoxal-5'-phosphat. | Gould, KG. and Engel, PC. 1980. Biochem J. 191: 365-71. PMID: 6786279
- Pyruvat-Decarboxylase katalysiert die Decarboxylierung von verzweigtkettigen 2-Oxo-Säuren, ist aber für die Fuselalkoholproduktion durch Saccharomyces cerevisiae nicht wesentlich. | ter Schure, EG., et al. 1998. Appl Environ Microbiol. 64: 1303-7. PMID: 9546164
- Eine enzymatische Methode zur automatischen Bestimmung von Oxalat mit dem Hitachi 911-Analysegerät. | Langman, LJ. and Allen, LC. 1998. Clin Biochem. 31: 429-32. PMID: 9721445
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
NAD+, Lithium Salt, 1 g | sc-208085 | 1 g | $272.00 |
