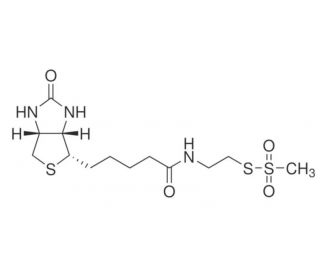
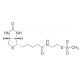
MTSEA Biotin (CAS 162758-04-5)
Direktverknüpfungen
MTSEA Biotin ist ein hoch vielseitiges biotinyliertes Thiol-Reagenz, das weit verbreitet in den Bereichen Biochemie und Molekularbiologie eingesetzt wird. Seine ausgezeichnete Eigenschaft ist seine Fähigkeit, sich kovalent an diverse Substrate zu binden, was es zu einem wertvollen Werkzeug für zahlreiche Anwendungen macht. NBME findet umfangreiche Verwendung bei der Proteinmodifizierung, Peptidsynthese, DNA/RNA-Kennzeichnung und Enzymassays. In der wissenschaftlichen Forschung hat MTSEA Biotin eine entscheidende Rolle bei Proteomik und molekularbiologischen Untersuchungen gespielt. Seine Anwendungen reichen von der Modifizierung von Proteinen, Peptiden und Nukleinsäuren bis hin zur Kennzeichnung von Enzymen und anderen Molekülen für diverse Assays. Darüber hinaus hat MTSEA Biotin es ermöglicht, die Studie der Protein-Protein-Interaktionen, die Erforschung der Proteinstruktur und Funktion sowie Untersuchungen der DNA- und RNA-Struktur und Funktion zu ermöglichen. Die Wirkung von MTSEA Biotin wird durch seine spezifische kovalente Bindung an verschiedene Substrate erreicht. Das Biotin-Molekül von NBME bindet spezifisch an die Biotin-Bindungsdomänen von Proteinen und anderen Molekülen, während das Thiol-Molekül an die Sulfhydrylgruppen von Proteinen und anderen Molekülen bindet. Wichtig ist, dass dieser Bindungsprozess reversibel ist, so dass MTSEA Biotin mithilfe chemischer oder enzymatischer Methoden vom Substrat entfernt werden kann.
MTSEA Biotin (CAS 162758-04-5) Literaturhinweise
- Kartierung der Agonisten-Bindungsstelle des GABAA-Rezeptors: Hinweise auf einen Beta-Strang. | Boileau, AJ., et al. 1999. J Neurosci. 19: 4847-54. PMID: 10366619
- Struktur und Dynamik der GABA-Bindungstasche: Ein sich verengender Spalt, der sich während der Aktivierung verengt. | Wagner, DA. and Czajkowski, C. 2001. J Neurosci. 21: 67-74. PMID: 11150321
- Untersuchung der Oberflächenexpression des renalen Typ IIa Na+/Pi-Cotransporters in Xenopus laevis-Oozyten. | Traebert, M., et al. 2001. J Membr Biol. 180: 83-90. PMID: 11284206
- Determinanten der Zinkpotenzierung an der alpha4-Untereinheit neuronaler Nikotinrezeptoren. | Hsiao, B., et al. 2006. Mol Pharmacol. 69: 27-36. PMID: 16189299
- Agonisten-, Antagonisten- und Benzodiazepin-induzierte strukturelle Veränderungen in der alpha1 Met113-Leu132-Region des GABAA-Rezeptors. | Kloda, JH. and Czajkowski, C. 2007. Mol Pharmacol. 71: 483-93. PMID: 17108261
- Direkter Nachweis, dass zwei Cysteine im Dopamintransporter eine Disulfidbindung bilden. | Chen, R., et al. 2007. Mol Cell Biochem. 298: 41-8. PMID: 17131045
- Individuelle Überwachung der ligandeninduzierten Veränderungen in der Struktur des GABAA-Rezeptors an der Benzodiazepin-Bindungsstelle und an den Schnittstellen zu den Nicht-Bindungsstellen. | Sharkey, LM. and Czajkowski, C. 2008. Mol Pharmacol. 74: 203-12. PMID: 18424553
- Die Alpha+Beta-Schnittstelle des GABAA-Rezeptors: ein neuer Angriffspunkt für selektive Medikamente des Subtyps. | Ramerstorfer, J., et al. 2011. J Neurosci. 31: 870-7. PMID: 21248110
- Die Rolle von ERp44 bei der Reifung des Serotonin-Transporterproteins. | Freyaldenhoven, S., et al. 2012. J Biol Chem. 287: 17801-17811. PMID: 22451649
- Kartierung funktionell wichtiger Residuen im Na+/Dicarboxylat-Cotransporter, NaDC1. | Colas, C., et al. 2017. Biochemistry. 56: 4432-4441. PMID: 28731330
- Reste in der achten Transmembrandomäne des protonengekoppelten Folat-Transporters (SLC46A1) spielen eine wichtige Rolle bei der Definition des wässrigen Translokationsweges und bei der Bindung von Folatsubstraten. | Aluri, S., et al. 2017. Biochim Biophys Acta Biomembr. 1859: 2193-2202. PMID: 28802835
- Substituierte Cysteinzugänglichkeit und Vernetzung identifizieren eine exofaziale Spalte in der 7. und 8. Helix des protonengekoppelten Folattransporters (SLC46A1). | Aluri, S., et al. 2018. Am J Physiol Cell Physiol. 314: C289-C296. PMID: 29167151
- Substitutionen, die den Protonen-gekoppelten Folat-Transporter (PCFT-SLC46A1) in einer nach innen offenen Konformation ver- und entriegeln. | Aluri, S., et al. 2019. J Biol Chem. 294: 7245-7258. PMID: 30858177
- Ein selektives und empfindliches Nachweissystem für 4-Thiouridin-Modifikationen in RNA. | Sugio, Y., et al. 2023. RNA. 29: 241-251. PMID: 36411056
- Bestimmung der Topologie der externen Schleife im Serotonintransporter durch ortsbezogene chemische Markierung. | Chen, JG., et al. 1998. J Biol Chem. 273: 12675-81. PMID: 9575231
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
MTSEA Biotin, 10 mg | sc-221960 | 10 mg | $213.00 |
