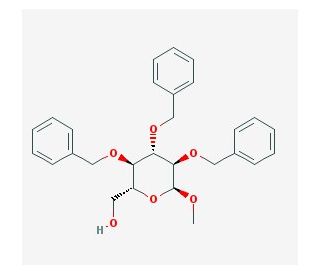
Methyl 2,3,4-tri-O-benzyl-α-D-glucopyranoside (CAS 53008-65-4)
Direktverknüpfungen
Methyl-2,3,4-tri-O-benzyl-α-D-glucopyranosid ist eine Spezialchemikalie, die hauptsächlich in der synthetischen organischen Chemie verwendet wird, insbesondere bei der Synthese komplexer Glykokonjugate. Seine Struktur mit dem Benzylschutz der Hydroxylgruppen 2, 3 und 4 des Glucosemoleküls macht es zu einem unschätzbaren Zwischenprodukt für den schrittweisen Aufbau von Oligosacchariden. Der selektive Schutz durch die Benzylgruppen ermöglicht spezifische Reaktionsbedingungen, unter denen andere ungeschützte Hydroxylgruppen reagieren können, was es zu einem wichtigen Instrument für die Steuerung von Glykosylierungsreaktionen macht. Diese Verbindung wird häufig für den Aufbau glykosidischer Bindungen durch Voraktivierungsstrategien und anschließende selektive Entschützung eingesetzt, wodurch die Synthese spezifischer und strukturell vielfältiger Glykostrukturen ermöglicht wird. Die Forschung, die diese Verbindung einsetzt, konzentriert sich in erster Linie auf das Verständnis von Kohlenhydrat-Interaktionen auf molekularer Ebene, die für die Entschlüsselung biologischer Prozesse wie Zellerkennung und Adhäsion entscheidend sind. Ihre Verwendung erstreckt sich auch auf die Untersuchung von Materialien auf Kohlenhydratbasis, wo die Präzision der molekularen Architektur zu Innovationen in der Biomaterialwissenschaft führen kann.
Methyl 2,3,4-tri-O-benzyl-α-D-glucopyranoside (CAS 53008-65-4) Literaturhinweise
- Gold-katalysierte Glykosidierung für die Synthese von Trisacchariden durch Anwendung der armed-disarmed Strategie. | Kayastha, AK. and Hotha, S. 2013. Beilstein J Org Chem. 9: 2147-55. PMID: 24204427
- Stereokontrollierte Synthese der äquatorialen Glykoside der 3-Deoxy-d-manno-oct-2-ulosonsäure: Die Rolle der Seitenkettenkonformation. | Ngoje, P. and Crich, D. 2020. J Am Chem Soc. 142: 7760-7764. PMID: 32275429
- Ein allgemeiner Ansatz zur O-Sulfatierung durch eine Schwefel(VI)-fluorid-Austauschreaktion. | Liu, C., et al. 2020. Angew Chem Int Ed Engl. 59: 18435-18441. PMID: 32644280
- Erforschung der biochemischen Grundlagen einer auf Glukose basierenden 'Trojanisches Pferd'-Strategie für die Borneutroneneinfangtherapie: Von der chemischen Synthese zur In-vitro-Bewertung. | Matović, J., et al. 2020. Mol Pharm. 17: 3885-3899. PMID: 32787269
- Einfluss der Substitution an der 5α-Position auf die Seitenkettenkonformation von Glucopyranosiden. | Rajasekaran, P., et al. 2021. Carbohydr Res. 500: 108254. PMID: 33561715
- Palladium(II)-unterstützte Aktivierung von Thioglykosiden. | Escopy, S., et al. 2021. Org Biomol Chem. 19: 2044-2054. PMID: 33599667
- Bismut(III)-triflat als neuartiger und effizienter Aktivator für Glycosylhalogenide. | Steber, HB., et al. 2021. Org Biomol Chem. 19: 3220-3233. PMID: 33885577
- Seitenkettenkonformation und ihr Einfluss auf die Glykosylierungsselektivität von Hexo- und höheren Kohlenstoff-Furanosiden. | Siyabalapitiya Arachchige, S. and Crich, D. 2022. J Org Chem. 87: 316-339. PMID: 34905382
- Effiziente Synthese von 2-OH Thioglycosiden aus Glycalen durch Reduktion von Aryldisulfiden mit NaBH4. | Guo, YF., et al. 2022. Molecules. 27: PMID: 36144712
- Aktivierung von Thioglykosiden mit Kupfer(II)bromid. | Pooladian, F., et al. 2022. Molecules. 27: PMID: 36364179
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Methyl 2,3,4-tri-O-benzyl-α-D-glucopyranoside, 1 g | sc-235702 | 1 g | $151.00 |
