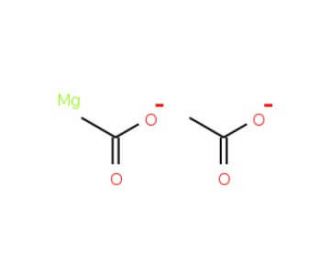
Magnesium acetate solution (CAS 142-72-3)
Direktverknüpfungen
Magnesiumacetatlösung ist eine wässrige Lösung von Magnesiumacetat, die häufig in der molekularbiologischen und biochemischen Forschung verwendet wird. Magnesiumacetat dient als Quelle für Magnesiumionen, die wichtige Cofaktoren für viele Enzyme sind, insbesondere für diejenigen, die an der Biochemie der Nukleinsäuren beteiligt sind. In der wissenschaftlichen Forschung ist der wichtigste Wirkmechanismus von Magnesiumacetat seine Rolle als Enzymaktivator. Magnesiumionen sind für die katalytische Aktivität verschiedener Enzyme unerlässlich, darunter DNA-Polymerasen und RNA-Polymerasen, die bei Prozessen wie der DNA-Replikation, der Transkription und der PCR (Polymerase-Kettenreaktion) eine zentrale Rolle spielen. Magnesiumionen stabilisieren die Strukturen von Enzymen und Nukleinsäuren, erleichtern die Bindung von Substraten und helfen bei der richtigen Positionierung der Reaktanten für die Katalyse. Außerdem wird Magnesiumacetat bei der Herstellung von Reaktionspuffern für enzymatische Reaktionen verwendet, bei denen eine genaue Konzentration von Mg²⁺ erforderlich ist, um eine optimale Enzymaktivität zu gewährleisten. Dies ist besonders wichtig bei Protokollen wie der PCR, wo die Magnesiumkonzentration die Ausbeute und Spezifität des amplifizierten Produkts erheblich beeinflussen kann.
Magnesium acetate solution (CAS 142-72-3) Literaturhinweise
- Direkte Synthese von geformten MgAPO-11-Molekularsieben und die katalytische Leistung bei der Hydroisomerisierung von n-Dodekan. | Wang, P., et al. 2021. RSC Adv. 11: 25364-25374. PMID: 35478881
- Eine „Säulen-Batch"-Methode zur Trennung von MB und LD1 in einer einzigen Fraktion. | Morin, LG. and Barton, EG. 1983. Clin Chem. 29: 1741-5. PMID: 6616818
- Elektrochemisches Verhalten von Stahl in Calcium-Magnesium-Acetat. | Kennelley, et al. 1990. Corrosion. 46.11: 888-895.
- Schwingungsspektroskopische Untersuchungen von Lösungen bei erhöhten Temperaturen und Drücken. 12. Magnesium-Acetat. | Semmler, et al. 1990. Geochimica et Cosmochimica Acta. 54.4: 947-954.
- Über die Kinetik der Hydratation von Magnesia in Magnesiumacetatlösungen. | Filippou and Dimitrios, et al. 1999. ournal of Chemical Technology & Biotechnology: International Research in Process, Environmental & Clean Technology. 74.4: 322-328.
- Hydratation von mittelreaktivem industriellem Magnesiumoxid mit Magnesiumacetat. | Van der Merwe, et al. 2004. Journal of thermal analysis and calorimetry. 77.1: 49-56.
- Wirkung von Natrium- und Magnesiumacetat auf das Lösungsverhalten einiger Aminosäuren in Wasser bei 298,15 K: Ein Kompressibilitätsansatz. | Banipal, et al. 2006. Zeitschrift für Physikalische Chemie. 220.8: 1049-1069.
- Einfluss der Hydratationszeit auf die Hydratation von MgO in Wasser und in einer Magnesiumacetatlösung. | Aphane, M., et al. 2009. Journal of Thermal Analysis and Calorimetry. 96.3: 987-992.
- Synthese von Mg(OH)2-Nanopartikeln aus MgO unter Verwendung von Magnesiumacetat als Zusatzstoff. | Kong, et al. 2012. Advanced Materials Research. 531: 467-470.
- Die Rolle von Magnesiumacetat bei der Hydratation und Karbonatisierung von Zementen auf Magnesiumoxidbasis. | Ilango and Nirrupama Kamala, et al. 2024. Cement and Concrete Research. 175: 107357.
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Magnesium acetate solution, 100 ml | sc-286142 | 100 ml | $35.00 | |||
Magnesium acetate solution, 500 ml | sc-286142A | 500 ml | $94.00 |
