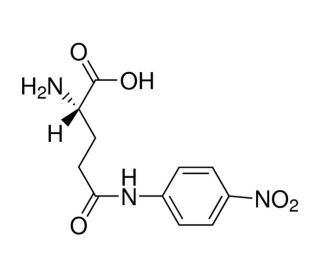
L-Glutamic acid γ-(4-nitroanilide) (CAS 7300-59-6)
Direktverknüpfungen
L-Glutaminsäure-γ-(4-Nitroanilid) ist eine Verbindung, die in verschiedenen biochemischen Assays als Substrat für das Enzym γ-Glutamyltransferase (GGT) dient. Bei der Verwendung in experimentellen Anwendungen dient L-Glutaminsäure-γ-(4-Nitroanilid) als spezifisches Substrat für GGT und ermöglicht die Messung der GGT-Aktivität in biologischen Proben. Bei der Wechselwirkung mit GGT wird L-Glutaminsäure-γ-(4-Nitroanilid) enzymatisch gespalten, was zur Freisetzung von 4-Nitroanilin führt. Diese Reaktion kann mit spektralphotometrischen Methoden quantitativ gemessen werden, was Aufschluss über das Niveau der GGT-Aktivität in biologischen Systemen gibt. Der Wirkmechanismus von L-Glutaminsäure-γ-(4-Nitroanilid) beinhaltet seine spezifische Erkennung und Spaltung durch das GGT-Enzym, was zur Bildung eines messbaren Produkts führt.
L-Glutamic acid γ-(4-nitroanilide) (CAS 7300-59-6) Literaturhinweise
- Nichtlineare Beziehung der freien Energie bei der durch allgemeine Säuren katalysierten Acylierung von Rattennieren-Gamma-Glutamyl-Transpeptidase durch eine Reihe von Gamma-Glutamyl-Anilid-Substrat-Analoga. | Ménard, A., et al. 2001. Biochemistry. 40: 12678-85. PMID: 11601992
- Die Charakterisierung der Helicobacter pylori-Gamma-Glutamyltranspeptidase zeigt die molekulare Grundlage für die Substratspezifität und eine entscheidende Rolle für die Tyrosin 433 enthaltende Schleife bei der Katalyse. | Morrow, AL., et al. 2007. Biochemistry. 46: 13407-14. PMID: 17960917
- Die Kristallstruktur von Acivicin-inhibierter gamma-Glutamyltranspeptidase zeigt, dass ihr C-Terminus eine entscheidende Rolle bei der Autoprozessierung und Katalyse spielt. | Williams, K., et al. 2009. Biochemistry. 48: 2459-67. PMID: 19256527
- Biochemische und strukturelle Eigenschaften der Gamma-Glutamyl-Transpeptidase aus Geobacillus thermodenitrificans: ein auf Hydrolase-Aktivität spezialisiertes Enzym. | Castellano, I., et al. 2010. Biochimie. 92: 464-74. PMID: 20138205
- Genklonierung und Proteinexpression von γ-Glutamyltranspeptidasen aus Thermus thermophilus und Deinococcus radiodurans: Vergleich der molekularen und strukturellen Eigenschaften mit mesophilen Gegenspielern. | Castellano, I., et al. 2011. Extremophiles. 15: 259-70. PMID: 21298394
- Charakterisierung von MtfA, einem neuen regulatorischen Ausgangssignalprotein des Glukose-Phosphotransferase-Systems in Escherichia coli K-12. | Göhler, AK., et al. 2012. J Bacteriol. 194: 1024-35. PMID: 22178967
- γ-Glutamyltranspeptidasen: Sequenz, Struktur, biochemische Eigenschaften und biotechnologische Anwendungen. | Castellano, I. and Merlino, A. 2012. Cell Mol Life Sci. 69: 3381-94. PMID: 22527720
- Donorsubstratspezifität der Rindernieren-Gamma-Glutamyltransferase. | Agblor, AA. and Josephy, PD. 2013. Chem Biol Interact. 203: 480-5. PMID: 23500672
- Partielle Reinigung und Eigenschaften von Gamma-Glutamyltranspeptidase aus Myzelien von Morchella esculenta. | Moriguchi, M., et al. 1986. Arch Microbiol. 144: 15-9. PMID: 2870692
- Verhalten von L-Gamma-Glutamyl-4-Nitroanilid und L-Gamma-Glutamyl-3-Carboxy-4-Nitroanilid in Bezug auf Gamma-Glutamyltransferasen unterschiedlicher Herkunft. | Verhoeff, PM., et al. 1988. Clin Chim Acta. 175: 129-34. PMID: 2900705
- Verteilung und Funktionscharakterisierung des Lysozyms vom Typ i aus Apostichopus japonicus. | Li, C., et al. 2018. Fish Shellfish Immunol. 74: 419-425. PMID: 29079205
- Eine photovernetzbare, aus der ECM der Niere gewonnene Biotinte beschleunigt die Bildung von Nierengewebe. | Ali, M., et al. 2019. Adv Healthc Mater. 8: e1800992. PMID: 30725520
- Biodistribution von Kupfer nach akuter systemischer Verabreichung von Kupfergluconat an Ratten. | García-Martínez, BA., et al. 2021. Biometals. 34: 687-700. PMID: 33900531
- Tridegin, ein neuer peptidischer Inhibitor des Faktors XIIIa, aus dem blutsaugenden Egel Haementeria ghilianii. | Finney, S., et al. 1997. Biochem J. 324 (Pt 3): 797-805. PMID: 9210403
- Analyse der kinetischen Eigenschaften der Gamma-Glutamyl-Transpeptidase aus der Rattenniere. | Dvoráková, L., et al. 1996. Gen Physiol Biophys. 15: 403-13. PMID: 9228521
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
L-Glutamic acid γ-(4-nitroanilide), 1 g | sc-250219 | 1 g | $48.00 |
