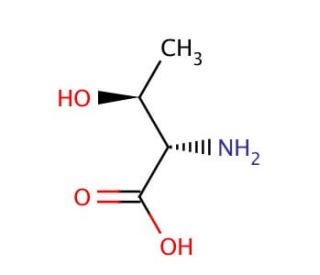
L-allo-Threonine (CAS 28954-12-3)
Direktverknüpfungen
L-Alo-Threonin ist ein Isomer der Aminosäure Threonin, das sich durch die Anordnung seiner molekularen Komponenten auszeichnet und einzigartige Eigenschaften aufweist, die zu einem Schwerpunkt in der biochemischen und strukturbiologischen Forschung geworden sind. Im Gegensatz zu seinem Gegenstück, dem L-Threonin, das während der Translation in Proteine eingebaut wird, kommt L-Alo-Threonin nicht in Proteinen vor und dient daher als Werkzeug zur Untersuchung von Proteinstruktur, -funktion und -stabilität. Forscher nutzen L-Alo-Threonin für die Untersuchung der Enzymspezifität, indem sie erforschen, wie Enzyme zwischen eng verwandten Substraten unterscheiden. Dieses Isomer spielt auch eine wichtige Rolle in der synthetischen Biologie, wo es zur Entwicklung neuartiger Proteine mit veränderten Aminosäuresequenzen verwendet wird, was die Untersuchung von Proteinfaltungsmechanismen und das Design von Proteinen mit neuen Funktionen ermöglicht. Darüber hinaus ist L-Alo-Threonin aufgrund seiner einzigartigen strukturellen Eigenschaften ein wertvoller Bestandteil bei der Entwicklung von Peptidomimetika, d. h. von Molekülen, die die Struktur von Peptiden nachahmen und zur Aufklärung von Wechselwirkungen auf molekularer Ebene verwendet werden, was Einblicke in die grundlegenden Prinzipien der molekularen Erkennung und Bindung ermöglicht.
L-allo-Threonine (CAS 28954-12-3) Literaturhinweise
- Röntgenstrukturen von Threonin-Aldolase-Komplexen: strukturelle Grundlage der Substraterkennung. | Kielkopf, CL. and Burley, SK. 2002. Biochemistry. 41: 11711-20. PMID: 12269813
- Charakterisierung von kurzkettigen Dehydrogenase/Reduktase-Homologen aus Escherichia coli (YdfG) und Saccharomyces cerevisiae (YMR226C). | Fujisawa, H., et al. 2003. Biochim Biophys Acta. 1645: 89-94. PMID: 12535615
- Auf dem Weg zur präparativen asymmetrischen Synthese von Beta-Hydroxy-alpha-Aminosäuren: Bildung von L-Alo-Threonin aus Glycin und Acetaldehyd mit rekombinantem GlyA. | Makart, S., et al. 2007. J Biotechnol. 130: 402-10. PMID: 17597243
- Bewertung des Threonin-Stoffwechsels in vivo durch Gaschromatographie/Massenspektrometrie und Infusion stabiler Isotope. | Ballèvre, O., et al. 1991. Anal Biochem. 193: 212-9. PMID: 1908193
- Entdeckung und Charakterisierung der D-Phenylserin-Desaminase aus Arthrobacter sp. TKS1. | Muramatsu, H., et al. 2011. Appl Microbiol Biotechnol. 90: 159-72. PMID: 21190106
- Linderung von Asthmasymptomen durch ein Derivat von L-Alo-Threonin. | Heo, JC. and Lee, SH. 2013. Int J Mol Med. 31: 881-7. PMID: 23381610
- Arg-265: ein kritischer Rest des zytosolischen SHMT von L. donovani zur Aufrechterhaltung der Bindung von THF und der Katalyse. | Gandhi, S., et al. 2015. Exp Parasitol. 149: 16-23. PMID: 25499510
- Die wichtige Rolle der Hydroxylgruppe für die konformationelle Anpassungsfähigkeit von Bis(l-threoninato)kupfer(II) im Vergleich zu Bis(l-allo-threoninato)kupfer(II): Quantenchemische Studie. | Marković, M., et al. 2016. Inorg Chem. 55: 7694-708. PMID: 27442350
- Wirkung der neuen Verbindung LX519290, einem Derivat von l-Alo-Threonin, auf das antioxidative Potenzial in vitro und in vivo. | Chun, K., et al. 2016. Int J Mol Sci. 17: PMID: 27598126
- L-Threonin und sein Analogon, die dem autoklavierten Festmedium zugesetzt werden, unterdrücken die Produktion von Trichothecen durch Fusarium graminearum. | Maeda, K., et al. 2017. Arch Microbiol. 199: 945-952. PMID: 28357472
- Biosynthese von Cyclochlorotin: Identifizierung der Gene, die an der oxidativen Umwandlung und der intramolekularen O,N-Transacylierung beteiligt sind. | Jiang, Y., et al. 2021. Org Lett. 23: 2616-2620. PMID: 33736433
- Terahertz-Spektroskopie-Studie der Stereoisomere von Threonin. | Zeng, R., et al. 2022. Appl Spectrosc. 76: 1132-1141. PMID: 35469427
- Wechselwirkungen zwischen Kupfer(II)-Ionen und L-Threonin, L-Alo-Threonin und L-Serin in wässriger Lösung. | Grenouillet, P., et al. 1973. Biochim Biophys Acta. 322: 185-94. PMID: 4765086
- Globomycin, ein neues Peptidantibiotikum mit sphäroplastenbildender Wirkung. III. Strukturelle Bestimmung von Globomycin. | Nakajima, M., et al. 1978. J Antibiot (Tokyo). 31: 426-32. PMID: 670085
- Genklonierung, biochemische Charakterisierung und physiologische Rolle einer thermostabilen L-Threonin-Aldolase niedriger Spezifität aus Escherichia coli. | Liu, JQ., et al. 1998. Eur J Biochem. 255: 220-6. PMID: 9692922
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
L-allo-Threonine, 250 mg | sc-255235 | 250 mg | $275.00 |
