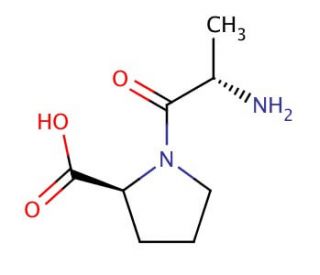
L-Alanyl-L-proline (CAS 13485-59-1)
Direktverknüpfungen
L-Alanyl-L-Prolin ist ein Alanyl-Dipeptid. Bei dieser spezifischen Anordnung befindet sich L-Alanin am N-Terminus und L-Prolin am C-Terminus. Beide Aminosäuren liegen in ihrer L-Konfiguration vor, die die natürlich vorkommende und biologisch aktive Form der meisten Aminosäuren in Proteinen ist. Das Vorhandensein von Prolin, einer zyklischen Aminosäure, neben einer anderen Aminosäure, einschließlich Alanin, kann interessante Auswirkungen auf die Sekundärstruktur von Peptiden und Proteinen haben. Prolin ist dafür bekannt, dass es aufgrund seiner starren zyklischen Struktur, die die Rotation um die N-Cα-Bindung einschränkt, einen Knick oder eine Drehung in die Polypeptidkette einführt. Diese Eigenschaft macht Dipeptide wie L-Alanyl-L-Prolin zu interessanten Studienobjekten für das Verständnis von Proteinfaltung, -struktur und -dynamik. In der biochemischen und biophysikalischen Forschung werden Dipeptide wie L-Alanyl-L-Prolin häufig verwendet, um die grundlegenden Prinzipien des Peptidverhaltens, wie Löslichkeit, Stabilität und Wechselwirkungen mit anderen Molekülen, zu untersuchen. Diese kleinen Peptide können als Modellsysteme dienen, um die Rolle spezifischer Aminosäurereste in größeren Proteinen zu erforschen, einschließlich der Frage, wie sie die Struktur und Funktion von Proteinen und die Interaktion mit anderen Biomolekülen beeinflussen.
L-Alanyl-L-proline (CAS 13485-59-1) Literaturhinweise
- Bestimmung der cis-trans-Isomerisierungsbarriere verschiedener L-Peptidyl-L-Prolin-Dipeptide durch dynamische Kapillarelektrophorese und Computersimulation. | Schoetz, G., et al. 2001. Electrophoresis. 22: 2409-15. PMID: 11519944
- Wasserstruktur um Dipeptide in wässrigen Lösungen. | McLain, SE., et al. 2008. Eur Biophys J. 37: 647-55. PMID: 18330556
- Ladungsbasierte Wechselwirkungen zwischen Peptiden, die als dominierende Kraft für die Assoziation in wässriger Lösung beobachtet wurden. | McLain, SE., et al. 2008. Angew Chem Int Ed Engl. 47: 9059-62. PMID: 18937237
- Bestimmung der cis-trans-Isomerisierungsbarrieren von L-Alanyl-L-Prolin in wässrigen Lösungen und an Wasser/hydrophoben Grenzflächen durch Online-Temperatursprung-Relaxations-HPLC und dynamische On-Column-Reaktions-HPLC. | Shibukawa, M., et al. 2015. Anal Chem. 87: 9280-7. PMID: 26320351
- Charakterisierung einer neuartigen Aminopeptidase P aus Trichinella spiralis und ihre Beteiligung an der Intrusion von Darmepithelzellen. | Zeng, J., et al. 2022. Exp Parasitol. 242: 108376. PMID: 36089006
- Analyse der Kinetik der cis-trans-Isomerisierung von L-Alanyl-L-Prolin mit Hilfe der Elutions-Band-Relaxationsmethode. | Hanai, R. and Wada, A. 1987. J Chromatogr. 394: 273-8. PMID: 3624338
- Enzymatische Eigenschaften der Prolin-Dipeptidase im Schweinedarm. | Sjöström, H. 1974. Acta Chem Scand B. 28: 802-8. PMID: 4472918
- Morphologie, Dipeptidasen und Disaccharidasen der Dünndarmschleimhaut bei chronischem Nierenversagen. | Denneberg, T., et al. 1974. Acta Med Scand. 195: 465-70. PMID: 4835154
- Morphologie, Dipeptidasen und Disaccharidasen der Dünndarmschleimhaut bei Vitamin B 12- und Folsäuremangel. | Berg, NO., et al. 1972. Scand J Haematol. 9: 167-73. PMID: 5037635
- Isolierung und Reinigung einer Prolidase aus der Schweinedarmschleimhaut. | Sjöström, H., et al. 1971. Acta Chem Scand. 25: 1911-3. PMID: 5107290
- Veränderungen der intestinalen Dipeptidase-Aktivitäten während der fötalen und neonatalen Entwicklung des Schweins im Zusammenhang mit der Ultrastruktur der Schleimhautzellen. | Lindberg, T. and Karlsson, BW. 1970. Gastroenterology. 59: 247-56. PMID: 5448200
- Spaltung der Arg1-Pro2-Bindung von Bradykinin durch eine Peptidase der menschlichen Lunge: Isolierung, Charakterisierung und Hemmung durch verschiedene Beta-Lactam-Antibiotika. | Sidorowicz, W., et al. 1984. Proc Soc Exp Biol Med. 175: 503-9. PMID: 6709646
- Menschliche Erythrozyten-Prolidase und Prolidase-Mangel. | Endo, F., et al. 1982. Pediatr Res. 16: 227-31. PMID: 7063276
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
L-Alanyl-L-proline, 5 g | sc-460127 | 5 g | $213.00 |
