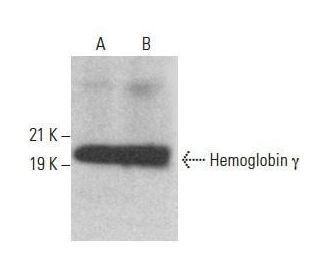

Hemoglobin γ Antikörper (B-4): sc-377395
- Hemoglobin gamma Antikörper B-4 ist ein monoklonales IgG3 aus der Maus in einer Menge von 200 µg/ml
- spezifisch für ein Epitop, welches zwischen den Aminosäuren 9-43 in der Nähe des N-terminus von Hemoglobin γ aus der Spezies human liegt
- Empfohlen für die Detektion von Hemoglobin γ aus der Spezies human per WB, IP, IF und ELISA
- Als Direktkonjugat zur Detektion von Hemoglobin γ wird Hemoglobin β/γ/δ/ε (A-8): sc-390668 angeboten; Primärantikörper konjugiert mit AC, HRP, FITC, PE, Alexa Fluor® 488, 594, 647, 680 und 790.
- Aktuell testen wir noch unsere Sekundärantikörper um das beste Bindeprotein für diesen Primärantikörper Hemoglobin γ (B-4) zu finden. Kontaktieren Sie uns bitte, wenn Sie Fragen hierzu haben sollten.
Direktverknüpfungen
Siehe auch...
Das Hämoglobin (Hgb) ist an vier eisenbindende, methenverknüpfte Tetrapyrrolringe (Häm) gekoppelt. Die Loci α (16p13.3; 5'-ζ-Pseudoz-Pseudo α2-Pseudo α1-α2-α1-œ1-3') und β (11p15.5) Globine bestimmen die grundlegende Hämoglobinstruktur. Der Globinteil des Hämoglobins besteht aus zwei α-Ketten und zwei β-Ketten, die paarweise angeordnet sind und ein Tetramer bilden. Jede der vier Globinketten verbindet sich kovalent mit einem Häm-Gruppen. Die Bindungen zwischen α- und β-Ketten sind schwächer als zwischen ähnlichen Globinketten, wodurch eine Spaltungsebene entsteht, die für die Sauerstoffbindung und -freisetzung wichtig ist. Bei Entspannung der α1-β2-Schnittstelle tritt eine hohe Affinität zu Sauerstoff auf. Wenn die beiden α1-β2-Schnittstellen eng gebunden sind, hat Hämoglobin eine geringe Affinität zu Sauerstoff. Hb A, das zwei α-Ketten plus zwei β-Ketten enthält, macht 97 % des gesamten zirkulierenden Hämoglobins aus. Der restliche 3 % des gesamten zirkulierenden Hämoglobins besteht aus Hb A-2, das zwei α-Ketten plus zwei δ-Ketten enthält, und fetalem Hämoglobin (Hb F), das zwei α-Ketten zusammen mit zwei γ-Ketten enthält.
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Hemoglobin γ Antikörper (B-4) | sc-377395 | 200 µg/ml | $322.00 | |||
Hemoglobin γ (B-4) Neutralizing Peptid | sc-377395 P | 100 µg/0.5 ml | $69.00 |

