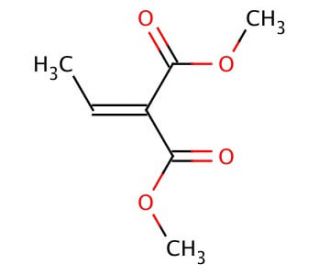
Molekülstruktur von Dimethyl ethylidenemalonate, CAS-Nummer: 17041-60-0
Dimethyl ethylidenemalonate (CAS 17041-60-0)
CAS Nummer:
17041-60-0
Molekulargewicht:
158.15
Summenformel:
C7H10O4
Ausschließlich für Forschungszwecke. Nicht Geeignet für Verwendung in Diagnostik oder Therapie.
* Schauen Sie auf das Analysezertifikat (CoA), um die genauen Daten (inkl. Wassergehalt) Ihrer Produktionscharge (Lot) zu sehen.
Direktverknüpfungen
Bestellinformation
Beschreibung
Hintergrundinformationen
Sicherheitshinweis
SDS (SDB) & Analysenzertifikate
Dimethyl Ethylidenemalonat (DME) ist eine synthetische Verbindung, die weitläufig in Laboratorien als Reagenz zur Synthese und als Katalysator in organischen Reaktionen verwendet wird. Die Wirkungsweise von DME basiert auf seiner Funktion als Inhibitor der Enzym Phosphorylase Kinase, die eine wesentliche Rolle bei der Regulation des Zellwachstums spielt. Durch die Bindung an das Enzym hemmt DME effektiv seine katalytische Aktivität, wodurch die Phosphorylierung von Proteinen verhindert wird. Da die Phosphorylierung für das Zellwachstum und die Zellteilung essentiell ist, wirkt diese Hemmung als Hemmschuh für die Zellproliferation.
Dimethyl ethylidenemalonate (CAS 17041-60-0) Literaturhinweise
- Neuartige Synthese von konjugierten Dienen, die an ein quaternäres Kohlenstoffzentrum gebunden sind, durch Pd(0)-katalysierte dekonjugative Allylierung von Alkenylidenemalonaten. | Sato, Y., et al. 2003. J Org Chem. 68: 9858-60. PMID: 14656125
- Katalytische asymmetrische Michael-Reaktionen mit Enamiden als Nukleophilen. | Berthiol, F., et al. 2007. Angew Chem Int Ed Engl. 46: 7803-5. PMID: 17768749
- Selektive deoxygenative Alkylierung von Alkoholen durch photokatalytische Domino-Radikalfragmentierung. | Guo, HM. and Wu, X. 2021. Nat Commun. 12: 5365. PMID: 34508098
- Photochemische Cycloaddition von Singulett-trans-Stilben mit alpha-, beta-ungesättigten Estern | Lewis, F. D., & DeVoe, R. J. 1980. The Journal of Organic Chemistry. 45(6): 948-951.
- Photochemische Umwandlungen. 26. Sensibilisierte und unsensibilisierte Photoreaktionen von einigen Benzylchloriden in tert-Butylalkohol | Cristol, S. J., & Bindel, T. H. 1980. The Journal of Organic Chemistry. 45(6): 951-957.
- Photochemische Synthese einiger Propellane durch [2+ 2]-Cycloaddition von Indeno[2,1-a]inden mit verschiedenen Olefinen | Shim, S. C., Chae, J. S., & Choi, J. H. 1983. The Journal of Organic Chemistry. 48(4): 417-421.
- Palladium-katalysierte [3+ 2]-Cycloaddition-Reaktion von Vinylcyclopropanen mit α,β-ungesättigten Estern oder Ketonen | Shimizu, I., Ohashi, Y., & Tsuji, J. 1985. Tetrahedron letters. 26(32): 3825-3828.
- Effizientes Verfahren zur Synthese von 1,4-disubstituierten 5-Carbomethoxypyrimidin-6-onen | Veale, C. A., Steelman, G. B., & Chow, M. M. 1993. The Journal of Organic Chemistry. 58(16): 4490-4493.
- Eine vielseitige Synthese von Acridin-1,9-Dionen | Chen, J., & Deady, L. W. 1997. Synthetic communications. 27(1): 95-106.
- Photocycloaddition-Reaktionen von Pyrazinopsoralen mit einfachen Olefinen | Han, G. S., & Shim, S. C. 1998. Photochemistry and photobiology. 67(1): 84-89.
- Kohlenstoff-Kohlenstoff-Bindungsreaktionen von N-gebundenen Übergangsmetall-α-Cyanocarbanionen: eine mechanistische Sonde für katalytische Michael-Reaktionen von Nitrilen | Naota, T., Tannna, A., & Murahashi, S. I. 2001. Chem. Commun. (1): 63-64.
- Katalytische enantioselektive Michael-Reaktion von 1,3-Dicarbonyl-Verbindungen durch Bildung eines chiralen Palladium-Enolats | Hamashima, Y., Hotta, D., Umebayashi, N., Tsuchiya, Y., Suzuki, T., & Sodeoka, M. 2005. Advanced Synthesis & Catalysis. 347(11‐13): 1576-1586.
- Selektive Michael-Additionen an Alkylidendemalonate mit bifunktionellen Organokatalysatoren auf Thioharnstoffbasis | Gavin, D. P., & Stephens, J. C. 2013. Arkivoc. 4: 76-87.
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Dimethyl ethylidenemalonate, 5 g | sc-227891 | 5 g | $112.00 |
