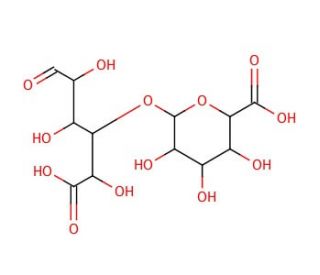
Digalacturonic acid (CAS 5894-59-7)
Produktreferenzen ansehen (2)
Direktverknüpfungen
Digalacturonsäure, ein Polysaccharid, das durch Verknüpfung zweier Galacturonsäuremoleküle durch eine Glykosidbindung gebildet wird, kommt natürlich in den Zellwänden zahlreicher Pflanzen und Algen vor. Ähnlich der Struktur von Cellulose dient Digalacturonsäure oft als Alternative zu Cellulose in verschiedenen Anwendungen. In der wissenschaftlichen Forschung wurde Digalacturonsäure umfangreich untersucht und ihre vielfältigen Vorteile entdeckt. Es wurde in der Produktion von Enzymen wie Pektinase und Xylanase eingesetzt, die beim Abbau von Pflanzenzellwänden helfen. Darüber hinaus war Digalacturonsäure bei der Synthese von Polysacchariden wie Cellulose von entscheidender Bedeutung, wodurch biologisch abbaubare Materialien hergestellt werden können. Außerdem wird es verwendet, um den Transport von Oligogalacturoniden durch Systeme wie den TogMNAB ABC-Transporter zu untersuchen. Obwohl das genaue Wirkungsmechanismus von Digalacturonsäure noch nicht vollständig verstanden ist, glaubt man, dass er auf seiner Fähigkeit beruht, sich mit Proteinen, Lipiden und Kohlenhydraten zu binden. Die stark verzweigte Struktur von Digalacturonsäure ermöglicht Interaktionen durch mehrere Wasserstoffbrücken mit anderen Molekülen.
Digalacturonic acid (CAS 5894-59-7) Literaturhinweise
- Segnalazione oligouronide dei geni inibitori delle proteinasi nelle piante: relazioni struttura-attività degli acidi di- e trigalatturonici e dei loro derivati. | Moloshok, T., et al. 1992. Arch Biochem Biophys. 294: 731-4. PMID: 1567229
- Abbau von Pektinstoffen durch zwei Pektatlyasen aus einem menschlichen Darmbakterium, Clostridium butyricum-beijerinckii-Gruppe. | Nakajima, N., et al. 1999. J Biosci Bioeng. 88: 331-3. PMID: 16232622
- Spezifische Erkennung von gesättigten und 4,5-ungesättigten Hexuronatzuckern durch ein periplasmatisches Bindungsprotein, das am Pektinkatabolismus beteiligt ist. | Abbott, DW. and Boraston, AB. 2007. J Mol Biol. 369: 759-70. PMID: 17451747
- Hochauflösende Struktur von Proteinase K, kokristallisiert mit Digalacturonsäure. | Larson, SB., et al. 2009. Acta Crystallogr Sect F Struct Biol Cryst Commun. 65: 192-8. PMID: 19255463
- Das pektinolytische Enzym von Selenomonas ruminantium. | Heinrichova, K., et al. 1989. J Appl Bacteriol. 66: 169-74. PMID: 2708171
- Metabolomics-Ansatz zeigt jährliche Stoffwechselvariationen in Wurzeln von Cyathula officinalis Kuan auf der Grundlage von Gaschromatographie-Massenspektren. | Tong, K., et al. 2017. Chin Med. 12: 12. PMID: 28469699
- Die Immobilisierung einer alkalischen, aus Bacillus paralicheniformis gereinigten Endopolygalacturonase zeigt eine Biofärbung von Baumwollstoffen. | Khan, MM., et al. 2018. Bioprocess Biosyst Eng. 41: 1425-1436. PMID: 29926218
- Simulierte Schwerelosigkeit stört das intestinale Metabolismusprofil von Ratten. | Jin, M., et al. 2019. Front Physiol. 10: 1279. PMID: 31680997
- Biochemische Charakterisierung einer Pektatlyase AnPL9 aus Aspergillus nidulans. | Suzuki, H., et al. 2022. Appl Biochem Biotechnol. 194: 5627-5643. PMID: 35802235
- Die pektischen Enzyme von Aspergillus niger. Eine zweite Exopolygalacturonase. | Mill, PJ. 1966. Biochem J. 99: 562-5. PMID: 4960793
- Die pektischen Enzyme von Aspergillus niger. Eine quecksilberaktivierte Exopolygalacturonase. | Mill, PJ. 1966. Biochem J. 99: 557-61. PMID: 5964957
- Eine Exo-Poly-alpha-D-Galakturonosidase, die an der Regulierung der extrazellulären Pektatlyase-Produktion in Erwinia chrysanthemi beteiligt ist. | Collmer, A., et al. 1982. J Bacteriol. 149: 626-34. PMID: 7056698
- Konformationsstudie von Digalakturonsäure und Natriumdigalakturonat in Lösung. | Gouvion, C., et al. 1994. Carbohydr Res. 261: 187-202. PMID: 7954511
- Aufnahme von Galakturonsäure in Erwinia chrysanthemi EC16. | San Francisco, MJ. and Keenan, RW. 1993. J Bacteriol. 175: 4263-5. PMID: 8320243
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Digalacturonic acid, 10 mg | sc-214891 | 10 mg | $148.00 | |||
Digalacturonic acid, 25 mg | sc-214891A | 25 mg | $255.00 | |||
Digalacturonic acid, 100 mg | sc-214891B | 100 mg | $823.00 |
