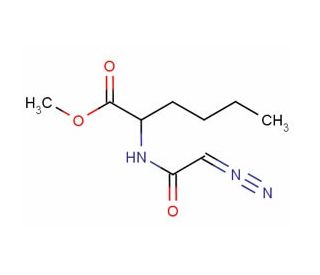
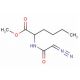
Diazoacetyl-DL-norleucine methyl ester (CAS 7013-09-4)
Produktreferenzen ansehen (1)
Direktverknüpfungen
Diazoacetyl-DL-Norleucin-Methyl-Ester, oder DANLE, ist ein synthetischer Derivat des Aminosäure-Norleucin und hat ein beträchtliches Interesse für seine potenziellen Anwendungen in der wissenschaftlichen Untersuchung erfahren. Seine Fähigkeit, Enzyme zu hemmen, die eine Rolle bei der Protein-Synthese spielen, hat es zu einer wichtigen Komponente in zahlreichen Laborversuchen gemacht. Die einzigartigen Eigenschaften von DANLE wurden in Studien zur Protein-Synthese in eukaryotischen Zellen und in Forschungen untersucht, die den Einfluss von Protein-Synthese-Inhibitoren auf Zellwachstum und -entwicklung untersuchen. DANLE ist auch in Studien zur Genexpression und den Auswirkungen der Genexpression auf Zellwachstum und Reifung enthalten. Die genaue Mechanik, durch die DANLE arbeitet, ist nicht vollständig bekannt. Dennoch wird angenommen, dass DANLE Enzyme, die an der Protein-Synthese beteiligt sind, durch Anbindung an die aktive Site des Enzyms behindert, wodurch das Substrat von der Bindung abgehalten wird. Darüber hinaus wird vorgeschlagen, dass DANLE möglicherweise mit anderen Enzymen interagieren könnte, die an der Protein-Synthese beteiligt sind, wie z.B. jenen, die an der mRNA-Translation beteiligt sind.
Diazoacetyl-DL-norleucine methyl ester (CAS 7013-09-4) Literaturhinweise
- Struttura e funzione delle proteasi acide. V. Studi comparativi sull'inibizione specifica delle proteasi acide da parte di diazoacetil-DL-norleucina estere metilico, 1,2-epossi-3-(p-nitrofenossi) propano e pepstatina. | Takahashi, K. and Chang, WJ. 1976. J Biochem. 80: 497-506. PMID: 10290
- Inibizione specifica delle proteasi acide di cervello, rene, muscolo scheletrico e piante insettivore da parte del diazoacetil-DL-norleucina estere metilico e della pepstatina. | Takahashi, K., et al. 1974. J Biochem. 76: 897-9. PMID: 4436292
- Struttura e funzione delle proteasi acide. Inattivazione specifica di una proteasi acida di Rhizopus chinensis da parte del diazoacetil-DL-norleucina metil estere. | Mizobe, F., et al. 1973. J Biochem. 73: 61-8. PMID: 4570372
- Ein Peptid aus dem aktiven Zentrum von Pepsin C. | Kay, J. and Ryle, AP. 1971. Biochem J. 123: 75-82. PMID: 4942834
- Proteaseaktivität im Zusammenhang mit dem Verlust der Adhäsionsfähigkeit bei Teratokarzinomen der Maus. | Meyer, JT., et al. 1983. Exp Cell Res. 143: 63-70. PMID: 6337856
- Purificazione e caratterizzazione di pepsinogeni e pepsine dell'orso nero asiatico e determinazione della sequenza aminoacidica dei 60 residui NH2-terminali del pepsinogeno maggiore. | Kageyama, T., et al. 1983. J Biochem. 94: 1557-67. PMID: 6418734
- Untersuchungen an Proteinasen aus den Verdauungsorganen der Sardine. II. Reinigung und Charakterisierung von zwei sauren Proteinasen aus dem Magen. | Noda, M. and Murakami, K. 1981. Biochim Biophys Acta. 658: 27-34. PMID: 6783105
- Eine Cathepsin D-ähnliche saure Proteinase aus der menschlichen Magenschleimhaut. Reinigung und Charakterisierung. | Kageyama, T. and Takahashi, K. 1980. J Biochem. 87: 725-35. PMID: 6993448
- Reinigung und Eigenschaften von Proteinase A aus Hefe. | Meussdoerffer, F., et al. 1980. J Biol Chem. 255: 12087-93. PMID: 7002931
- Struttura e funzione delle proteasi acide. IX. Isolamento e sequenze aminoacidiche dei peptidi contenenti i residui aspartilici del sito attivo reattivi con l'estere metilico di diazoacetil-DL-norleucina e l'1,2-epossido-3-(p-nitrofenossi)propano nella proteasi acida di Rhizopus chinensis. | Nakamura, S. and Takahashi, K. 1978. J Biochem. 84: 1593-600. PMID: 739006
- Charakterisierung einer thermostabilen, Pepstatin-unempfindlichen sauren Proteinase aus einem Bacillus sp. | Prescott, M., et al. 1995. Int J Biochem Cell Biol. 27: 729-39. PMID: 7648429
- Eine Pepstatin-unempfindliche Asparagin-Proteinase aus einem thermophilen Bacillus sp. | Toogood, HS., et al. 1995. Biochem J. 307 (Pt 3): 783-9. PMID: 7741709
- Reinigung und Charakterisierung von Kumamolysin, einer neuartigen thermostabilen Pepstatin-unempfindlichen Carboxylproteinase aus Bacillus novosp. MN-32. | Murao, S., et al. 1993. J Biol Chem. 268: 349-55. PMID: 8416942
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Diazoacetyl-DL-norleucine methyl ester, 250 mg | sc-294298 | 250 mg | $102.00 | |||
Diazoacetyl-DL-norleucine methyl ester, 1 g | sc-294298A | 1 g | $204.00 |
