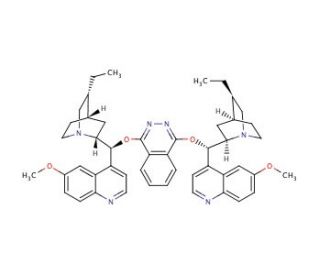
(DHQD)2PHAL (CAS 140853-10-7)
Direktverknüpfungen
(DHQD)2PHAL ist ein chiraler Ligand, der weit verbreitet in der asymmetrischen Syntheseforschung verwendet wird. Dieser Ligand ist besonders wertvoll in der Studie der enantioselektiven Katalyse, wo er Komplexe mit verschiedenen Metallen bildet, um Reaktionen zu katalysieren, die chirale Moleküle mit hoher Selektivität produzieren. Seine Wirksamkeit bei der Katalyse einer Vielzahl von Reaktionen, einschließlich, aber nicht beschränkt auf, asymmetrische Epoxidation, Diels-Alder- und Michael-Additionsreaktionen, macht es zu einem Stoff von erheblichem Interesse für die Verbesserung industrieller synthetischer Prozesse. Darüber hinaus wird (DHQD)2PHAL auch in mechanistischen Studien verwendet, um die grundlegenden Prinzipien der Chiralität und ihren Einfluss auf Reaktionswege und Ergebnisse zu verstehen. Auch die Rolle dieses Liganden bei der Förderung des Bereichs der grünen Chemie wird hervorgehoben, da er bei der Schaffung umweltfreundlicherer Prozesse hilft, indem er den Bedarf an überschüssigen Reagenzien und Nebenprodukten reduziert.
(DHQD)2PHAL (CAS 140853-10-7) Literaturhinweise
- Katalytische asymmetrische Dihydroxylierung unter Verwendung von neuartigem mikroverkapseltem Osmiumtetroxid (PEM-MC OsO4) auf der Basis von Phenoxyethoxymethyl-Polystyrol (PEM). | Kobayashi, S., et al. 2001. Org Lett. 3: 2649-52. PMID: 11506600
- Osmium-katalysierte asymmetrische Dihydroxylierung von Olefinen durch H2O2; Doppelrolle des Cinchona-Alkaloid-Liganden. | Jonsson, SY., et al. 2001. Org Lett. 3: 3463-6. PMID: 11678683
- Ein trifunktionaler Katalysator für die Eintopfsynthese chiraler Diole über Heck-Kopplung-N-Oxidation-asymmetrische Dihydroxylierung: Anwendung für die Synthese von Diltiazem und Taxol-Seitenkette. | Choudary, BM., et al. 2003. J Org Chem. 68: 1736-46. PMID: 12608786
- MTO und OsO4: ein effizientes katalytisches Paar für die milde H2O2-basierte asymmetrische Dihydroxylierung von Olefinen. | Jonsson, SY., et al. 2003. Chemistry. 9: 2783-8. PMID: 12866542
- Diastereoselektive Synthese von allen acht l-Hexosen aus L-Ascorbinsäure. | Ermolenko, L. and Sasaki, NA. 2006. J Org Chem. 71: 693-703. PMID: 16408982
- Chemoselektive asymmetrische N-allylische Alkylierung von Indolen mit Morita-Baylis-Hillman-Carbonaten. | Cui, HL., et al. 2009. Angew Chem Int Ed Engl. 48: 5737-40. PMID: 19554585
- Enantioselektive, desymmetrisierende Bromolactonisierung von Alkinen. | Wilking, M., et al. 2013. J Am Chem Soc. 135: 8133-6. PMID: 23679927
- Enantioselektive Chlorocyclisierung von Indol-abgeleiteten Benzamiden für die Synthese von Spiro-Indolinen. | Yin, Q. and You, SL. 2013. Org Lett. 15: 4266-9. PMID: 23909796
- Entschlüsselung der stereokontrollierenden Elemente einer katalytischen asymmetrischen Chlorolactonisierung: Synaddition vermeidet verbrückendes Chloronium. | Yousefi, R., et al. 2013. J Am Chem Soc. 135: 14524-7. PMID: 24025085
- N-Trifluormethylthiophthalimid: ein stabiles elektrophiles SCF3 -Reagenz und seine Anwendung bei der katalytischen asymmetrischen Trifluormethylsulfenylierung. | Bootwicha, T., et al. 2013. Angew Chem Int Ed Engl. 52: 12856-9. PMID: 24123914
- Skalierbare Lösungsphasensynthese des biologisch aktiven Cyclodepsipeptids Destruxin E, eines wirksamen negativen Regulators der Osteoklastenmorphologie. | Yoshida, M., et al. 2014. J Org Chem. 79: 296-306. PMID: 24251640
- Asymmetrische Chlorocyclisierung von Indol-3-yl-benzamiden zur Herstellung von kondensierten Indolinen. | Yin, Q. and You, SL. 2014. Org Lett. 16: 2426-9. PMID: 24730758
- Katalytische und hoch enantioselektive Selenolactonisierung. | Niu, W. and Yeung, YY. 2015. Org Lett. 17: 1660-3. PMID: 25763679
- Diastereodivergente und enantioselektive [4+2] Annulationen von γ-Butenoliden mit cyclischen 1-Azadienen. | Li, C., et al. 2015. Molecules. 20: 13642-58. PMID: 26225947
- Organokatalytische asymmetrische chlorinative Dearomatisierung von Naphtholen. | Yin, Q., et al. 2015. Chem Sci. 6: 4179-4183. PMID: 29218183
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
(DHQD)2PHAL, 1 g | sc-239665 | 1 g | $143.00 |
