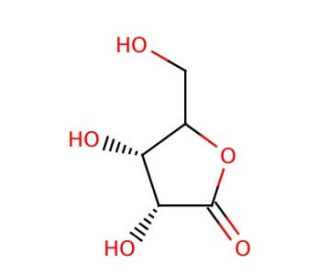
D-Ribonolactone (CAS 5336-08-3)
Direktverknüpfungen
D-Ribonolacton, ein zyklisches Zuckerlacton, das sich von Ribose ableitet, hat sich als wichtiges Molekül in verschiedenen Forschungsbemühungen erwiesen, insbesondere in den Bereichen Biochemie, Enzymologie und organische Synthese. Aufgrund seiner chemischen Struktur, die durch einen fünfgliedrigen Lactonring gekennzeichnet ist, eignet es sich hervorragend für die Untersuchung der Kohlenhydratchemie und enzymatischer Umwandlungen. In der Forschung dient D-Ribonolacton als Substrat für Enzyme wie Lactonasen und lactonisierende Enzyme, die seine Hydrolyse zur Bildung von D-Ribose katalysieren, einem grundlegenden Zuckermolekül, das an zahlreichen biologischen Prozessen beteiligt ist. Dieser enzymatische Hydrolysemechanismus wird umfassend untersucht, um die Wechselwirkungen zwischen Enzym und Substrat, die katalytischen Mechanismen und die Substratspezifität zu verstehen, was Einblicke in die Enzymkinetik und die Strategien der Proteinentwicklung ermöglicht. Darüber hinaus wird D-Ribonolacton als Vorläufer bei der Synthese von ribosehaltigen Verbindungen, einschließlich Nukleosiden, Nukleotiden und Kohlenhydratderivaten, verwendet, was die Entwicklung neuartiger Biomoleküle mit potenziellen Anwendungen in der Arzneimittelentdeckung, der Molekularbiologie und der chemischen Biologieforschung erleichtert. Seine vielseitige Rolle als Ausgangsmaterial in der organischen Synthese ermöglicht den Aufbau verschiedener chemischer Bibliotheken und molekularer Sonden für die Untersuchung biologischer Systeme und die Entwicklung von Wirkstoffen. Insgesamt ist D-Ribonolacton weiterhin ein wertvolles Instrument für die wissenschaftliche Forschung und trägt zu Fortschritten in der Kohlenhydratchemie, Enzymologie und synthetischen Biologie bei.
D-Ribonolactone (CAS 5336-08-3) Literaturhinweise
- Entdeckung eines niedermolekularen Insulinmimetikums mit antidiabetischer Wirkung bei Mäusen. | Zhang, B., et al. 1999. Science. 284: 974-7. PMID: 10320380
- Kurzsynthese von enantiomerenreinem C2-symmetrischem 1,2:4,5-Diepoxypentan und 'pseudo'-C2-symmetrischem 3-Azido-1,2:4,5-Diepoxypentan aus Arabitol. | Boydell, AJ., et al. 2003. J Org Chem. 68: 8252-5. PMID: 14535812
- Kompensation von Matrixeffekten bei der Gaschromatographie-Massenspektrometrie-Analyse von 186 Pestiziden in Teematrices unter Verwendung von Analytenschutzmitteln. | Li, Y., et al. 2012. J Chromatogr A. 1266: 131-42. PMID: 23102633
- Nukleoside. CXLVIII. Synthese von 6-(beta-D-ribofuranosyl)picolinamid. Ein neues C-Nukleosid aus D-Ribonolacton. | Kabat, MM., et al. 1988. Chem Pharm Bull (Tokyo). 36: 634-40. PMID: 3136937
- Umfassende Analyse von 201 Pestiziden für verschiedene pflanzliche Arten - anwendungsbereit mit Gaschromatographie-Tandem-Massenspektrometrie gekoppelt mit QuEChERs. | Fu, Y., et al. 2019. J Chromatogr B Analyt Technol Biomed Life Sci. 1125: 121730. PMID: 31374421
- Sandwich-Injektion und Analytenschutzmittel als Möglichkeit zur Verringerung der durch den Matrixeffekt bedingten Drift zwischen Bracketing-Kalibrierungen bei GC-MS/MS: Eine Fallstudie. | Soliman, M. 2021. Talanta. 225: 121970. PMID: 33592804
- Grüne Synthese von 1,5-Dideoxy-1,5-imino-Ribitol und 1,5-Dideoxy-1,5-imino-DL-Arabinitol aus natürlichen D-Zuckern über Au/Al2O3- und SO42-/Al2O3-Katalysatoren. | Gao, H. and Fan, A. 2021. Sci Rep. 11: 16928. PMID: 34413372
- Ein einfacher und allgemeiner Zugang zu optisch aktiven Pheromonen und Aromen mit γ-Alkyl-γ-lacton-Strukturen. Eine Studie über einige Laktonderivate von Pentosen† | and J. Cardellach, J. Font, R. M. Ortuño.: March/April 1984. Journal of heterocyclic chemistry. Volume21, Issue2: Pages 327-331.
- Stereokontrollierte Synthesen von 6-Epi-Trehazolin und 6-Epi-Trehalamin aus D-Ribonolacton | Masao Shiozaki, Masami Arai, Yoshiyuki Kobayashi, Atsushi Kasuya, Shuichi Miyamoto, Youji Furukawa, Tomoko Takayama, and Hideyuki Haruyama. 1994. J. Org. Chem. 59: 4450-4460.
- Eine prägnante, effiziente und großtechnische Synthese eines geschütztenL -Lyxonolacton-Derivats: Ein wichtiger Aldonolacton-Kern | Hitesh Batra, Robert M. Moriarty, Raju Penmasta, Vijay Sharma, Gabriela Stanciuc, James P. Staszewski, and Sudersan M. Tuladhar, and David A. Walsh. 2006. Organic Process Research & Development. 10: 484−486.
- Eine hochgradig stereokontrollierte und effiziente Synthese von α- und β-Pseudouridinen | Stephen Hanessian* and Roger Machaalan. 3 November 2003. Tetrahedron Letters Issue 45. Volume 44: Pages 8321-8323.
- Ein Ribonolacton-basierter Ansatz zur Synthese von 1′-Kohlenstoff-substituierten Thymin-Ribonukleosiden | Hiroyuki Hayakawa, et al. 1994 - Issue 1-3. Nucleosides and Nucleotides. Volume 13,: 297-308.
- Synthese von Zuckern aus D-Ribonolacton. II. Eine alternative Synthese von D-Erythrose | Ramesh H. Shah. Received 09 Sep 1985, Accepted 06 Dec 1985, Published online: 21 May 2008. Journal of Carbohydrate Chemistry. Volume 5, 1986 - Issue 1: Pages 139-146.
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
D-Ribonolactone, 5 g | sc-221517 | 5 g | $169.00 |
