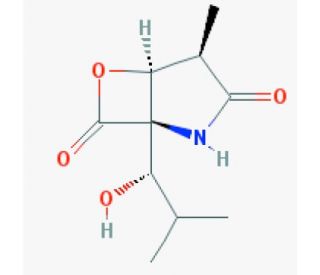
clasto-Lactacystin β-lactone (CAS 155975-72-7)
Produktreferenzen ansehen (1)
Direktverknüpfungen
Clasto-Lactacystin-β-Lacton (CAS: 155975-72-7) ist eine Chemikalie von erheblichem Interesse, vor allem wegen ihrer Rolle als Vorläufer von Lactacystin, einem faszinierenden Molekül in der biochemischen Forschung wegen seiner Fähigkeit, die Proteasom-Aktivität zu modulieren. Clasto-Lactacystin β-Lacton selbst verwandelt sich bei der Metabolisierung in Lactacystin, das anschließend mit dem Proteasom interagiert, einem Proteinkomplex, der für den Abbau unerwünschter oder fehlgefalteter Proteine in den Zellen verantwortlich ist. Die spezifische Wirkung von Clasto-Lactacystin-β-Lacton besteht in seiner Umwandlung in Clasto-Lactacystin-Dihydroxysäure in Anwesenheit von zellulären Nukleophilen, die dann die proteasomale Aktivität hemmt, indem sie spezifisch auf die proteolytischen β-Untereinheiten innerhalb des 20S-Kerns des Proteasoms zielt. Diese Hemmung ist von entscheidender Bedeutung für die Untersuchung der Mechanismen des Proteinabbaus unter verschiedenen physiologischen Bedingungen und ermöglicht so Einblicke in die Regulierung des Proteinumsatzes und seine Auswirkungen auf die Zellfunktionen. Die Forscher nutzen Clasto-Lactacystin-β-Lacton, um die Dynamik der Proteasom-Hemmung und ihre Auswirkungen auf die Protein-Homöostase in Zellen zu untersuchen.
clasto-Lactacystin β-lactone (CAS 155975-72-7) Literaturhinweise
- Neuritenauswuchs in PC12-Zellen. Unterscheidung der Rollen von Ubiquitylierung und Ubiquitin-abhängiger Proteolyse. | Obin, M., et al. 1999. J Biol Chem. 274: 11789-95. PMID: 10206996
- Ein neuer enantioselektiver Syntheseweg zu Omuralid-Analoga mit dem Potenzial für Spezies-Selektivität bei der Proteasom-Inhibition. | Crane, SN. and Corey, EJ. 2001. Org Lett. 3: 1395-7. PMID: 11348243
- Proteasom-Inhibitoren: von Forschungsinstrumenten zu Arzneimittelkandidaten. | Kisselev, AF. and Goldberg, AL. 2001. Chem Biol. 8: 739-58. PMID: 11514224
- Einfache enantiospezifische Synthesen der C(2)-Diastereomere von Omuralid und 3-Methylomuralid. | Reddy, LR., et al. 2005. Org Lett. 7: 2703-5. PMID: 15957926
- Proteasom-Inhibition durch ein vollständig synthetisches Beta-Lactam, das mit Salinosporamid A und Omuralid verwandt ist. | Hogan, PC. and Corey, EJ. 2005. J Am Chem Soc. 127: 15386-7. PMID: 16262399
- Vorhersage des Wirkmechanismus von Omuralid (Clasto-Lactacystin-Beta-Lacton) auf menschliches Cathepsin A auf der Grundlage eines Strukturmodells des Komplexes Hefe-Proteasom Beta5/PRE2-Untereinheit/Omuralid. | Aikawa, S., et al. 2006. Biochim Biophys Acta. 1764: 1372-80. PMID: 16870514
- Neuer Zugang zu konvertierbaren Isocyaniden für die Ugi-Reaktion und ihre Anwendung auf die stereokontrollierte formale Totalsynthese des Proteasom-Inhibitors Omuralid. | Gilley, CB., et al. 2007. Org Lett. 9: 3631-4. PMID: 17672474
- Stereospezifische Totalsynthesen der Proteasominhibitoren Omuralid und Lactacystin. | Gu, W. and Silverman, RB. 2011. J Org Chem. 76: 8287-93. PMID: 21916437
- Omuralid und Vibralacton: Unterschiede im Proteasom- β-Lacton-γ-Lactam-Bindungsgerüst verändern die Zielpräferenzen. | List, A., et al. 2014. Angew Chem Int Ed Engl. 53: 571-4. PMID: 24285701
- Stereokontrollierter Zugang zu δ-Lacton-kondensierten-γ-Lactamen mit winkligen benzylischen quaternären Stereozentren. | Beng, TK., et al. 2022. RSC Adv. 12: 17617-17620. PMID: 35765420
- Hemmung der Proteasom-Aktivitäten und der spezifischen aminoterminalen Threonin-Modifikation der Untereinheiten durch Lactacystin. | Fenteany, G., et al. 1995. Science. 268: 726-31. PMID: 7732382
- Mechanistische Studien über die Inaktivierung des Proteasoms durch Lactacystin in kultivierten Zellen. | Dick, LR., et al. 1997. J Biol Chem. 272: 182-8. PMID: 8995245
- Totalsynthese und biologische Aktivität von Lactacystin, Omuralid und Analoga. | Corey, EJ. and Li, WD. 1999. Chem Pharm Bull (Tokyo). 47: 1-10. PMID: 9987821
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
clasto-Lactacystin β-lactone, 100 µg | sc-202106 | 100 µg | $254.00 |
