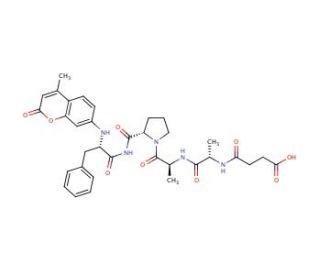
Chymotrypsin Substrate II, Fluorogenic (CAS 88467-45-2)
Direktverknüpfungen
Chymotrypsin Substrate II, Fluorogenic ist ein speziell entwickeltes Peptid, das als Substrat für das Enzym Chymotrypsin dient. Chymotrypsin ist eine Verdauungsprotease, die Peptidbindungen an der Carboxylseite von aromatischen Aminosäuren wie Tyrosin, Tryptophan und Phenylalanin spaltet. Der fluorogene Aspekt dieses Substrats bedeutet, dass es bei der enzymatischen Spaltung durch Chymotrypsin ein fluoreszierendes Signal freisetzt, so dass die Aktivität des Enzyms in Echtzeit überwacht werden kann. Diese Eigenschaft macht es zu einem unschätzbaren Werkzeug für verschiedene Forschungs- und Analyseanwendungen, insbesondere für die Untersuchung der Proteaseaktivität und das Screening von Inhibitoren. Durch die Messung des Anstiegs der Fluoreszenzintensität bei der Spaltung des Substrats können die Forscher die Geschwindigkeit, die Substrataffinität (Km) und die katalytische Effizienz (kcat) des Enzyms bestimmen und so Einblicke in seinen katalytischen Mechanismus gewinnen.
Chymotrypsin Substrate II, Fluorogenic (CAS 88467-45-2) Literaturhinweise
- Nachweis, dass Cyclophilin-A Zellen vor oxidativem Stress schützt. | Doyle, V., et al. 1999. Biochem J. 341 (Pt 1): 127-32. PMID: 10377253
- Cyclophilin-A ist an der Excitotoxin-induzierten Caspase-Aktivierung in neuronalen B50-Zellen der Ratte beteiligt. | Capano, M., et al. 2002. Biochem J. 363: 29-36. PMID: 11903043
- Entwicklung von Protease-Assays auf der Grundlage der induktiv gekoppelten Plasma-Massenspektrometrie. | Lathia, US., et al. 2010. Anal Biochem. 398: 93-8. PMID: 19912984
- Funktionelle Expression eines neuartigen Proteaseinhibitors vom Kunitz-Typ aus dem menschlichen Blutegel Schistosoma mansoni. | Ranasinghe, SL., et al. 2015. Parasit Vectors. 8: 408. PMID: 26238343
- Klonierung und Charakterisierung von zwei potenten Proteaseinhibitoren vom Typ Kunitz aus Echinococcus granulosus. | Ranasinghe, SL., et al. 2015. PLoS Negl Trop Dis. 9: e0004268. PMID: 26645974
- Synergistische Aktivität zwischen zwei antimykotischen Proteinen, dem pflanzlichen Defensin NaD1 und dem Trypsin-Inhibitor des Rinderpankreas. | Bleackley, MR., et al. 2017. mSphere. 2: PMID: 29062897
- Kristallstrukturen des Komplexes eines Kallikrein-Inhibitors aus Bauhinia bauhinioides mit Trypsin und Modellierung von Kallikrein-Komplexen. | Li, M., et al. 2019. Acta Crystallogr D Struct Biol. 75: 56-69. PMID: 30644845
- Die Aufnahme von Chymase durch Kardiomyozyten führt zu einem Myosinabbau bei kardialer Volumenüberlastung. | Powell, PC., et al. 2019. Heliyon. 5: e01397. PMID: 30997426
- Die Hemmung von Cathepsin G durch Serpinb1 und Serpinb6 verhindert die programmierte Nekrose in Neutrophilen und Monozyten und verringert die GSDMD-bedingte Entzündung. | Burgener, SS., et al. 2019. Cell Rep. 27: 3646-3656.e5. PMID: 31216481
- Screening und Identifizierung von Metacaspase-Inhibitoren: Bewertung des Hemmungsmechanismus und der Trypanozid-Aktivität. | Pérez, B., et al. 2021. Antimicrob Agents Chemother. 65: PMID: 33318019
- Reversible photoschaltbare Inhibitoren erzeugen Ultrasensitivität bei enzymatischen Reaktionen außerhalb des Gleichgewichts. | Teders, M., et al. 2021. J Am Chem Soc. 143: 5709-5716. PMID: 33844531
- Proteolytische Spaltung bioaktiver Peptide und Protease-aktivierter Rezeptoren bei akuter und post-Kolitis. | De Bruyn, M., et al. 2021. Int J Mol Sci. 22: PMID: 34639054
- Die Wirkung von Serinprotease-Inhibitoren auf viszerale Schmerzen in verschiedenen Nagetiermodellen mit einer intestinalen Insultation. | Ceuleers, H., et al. 2022. Front Pharmacol. 13: 765744. PMID: 35721192
- Extrazelluläre enzymatische Aktivitäten von ozeanischen pelagischen Pilzstämmen und der Einfluss der Temperatur. | Salazar Alekseyeva, K., et al. 2022. J Fungi (Basel). 8: PMID: 35736054
- Entdeckung und molekulare Grundlagen von subtypselektiven Cyclophilin-Inhibitoren. | Peterson, AA., et al. 2022. Nat Chem Biol. 18: 1184-1195. PMID: 36163383
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
Chymotrypsin Substrate II, Fluorogenic, 25 mg | sc-391097 | 25 mg | $193.00 |
